Издание одобрено учёным советом Челябинской государственной медицинской академии (28 мая 2004 года.)
УДК 616.36–004–06:616.149-008.341.1+616.329/33-005
Гарбузенко Д. В.
Кровотечения из
варикозно расширенных вен пищевода и желудка у больных циррозом печени:
патогенез, профилактика, лечение. – Челябинск: Издательский
дом «Восточные
Ворота», 2004. – 63 c.
В методическом пособии
рассмотрены
анатомо-физиологические особенности гемодинамики печени, с современных
позиций
освещены вопросы патогенеза портальной гипертензии при циррозе печени,
выделены
факторы риска кровотечений из варикозно расширенных вен пищевода и
желудка.
Представлен обзор способов профилактики и лечения этого осложнения, а
на основе
собственных наблюдений и литературных данных описана лечебная тактика у
больных
с портальной гипертензией. Отдельный раздел пособия посвящен
разработанному в
клинике оригинальному методу лапароскопической лазерной
реваскуляризации печени
при циррозе.
Издание рассчитано на хирургов, гастроэнтерологов, реаниматологов.
Garbuzenko
D.V. Gastroesophageal variceal bleeding in patients with
cirrhosis: pathogenesis, prophylactic, treatment.
In
methodical textbook are considered the anatomist-physiological
particularity of
hepatic hemodynamics, with modern positions are refreshed the questions
of
pathogenesis of portal hypertension at liver cirrhosis, is chosen
factor of
risk of gastroesophageal variceal bleeding. Presented review of ways of
preventive maintenance and treatments of this complication, and on base
of own
observations and literary given is described medical tactics in
patients with
portal hypertension. Separate section of allowance is denoted designed
in
clinic original method an lazer revascularization cirrhotc liver.
Рецензент: Зав. кафедрой госпитальной хирургии ЧГМА, доктор медицинских наук, профессор И.А. Андриевских
Ни одна
из частей этой книги не может быть
перепечатана и воспроизведена в любом виде (электронном, механическом,
фотографическом,
письменном и др.), полностью или частями, без письменного разрешения
автора.
Моей дочери
Анастасии,
вступающей в
новый мир
познания…
ВВЕДЕНИЕ
Практикующие врачи всегда испытывают потребность в литературе, где в сжатой форме, но на современном научном уровне были бы изложены рекомендации по лечению неотложных состояний, встречающихся в клинике внутренних болезней. Кровотечения из варикозно расширенных вен пищевода и желудка у больных циррозом печени являются одними из них.
Лечение больных циррозом печени до настоящего времени остается актуальной проблемой. Во многих развитых странах мира это хроническое прогрессирующее заболевание лидирует по частоте летальных исходов среди доброкачественных болезней органов пищеварения у людей трудоспособного возраста, а в общей структуре смертности занимает четвертое место. Количество пациентов с циррозом печени как в России, так и в США и во многих государствах Европы продолжает увеличиваться, что связано с широким распространением хронической алкогольной интоксикации и увеличением лиц, перенесших вирусные гепатиты В, С или являющихся вирусоносителями. Статистика свидетельствует, что только в России насчитывается около 10 млн больных алкоголизмом, а вирусами гепатитов В, С инфицировано 300-350 млн человек в мире.
Портальная гипертензия - ведущий синдром, характерный для цирроза печени, наиболее опасным проявлением которого служат кровотечения из варикозно расширенных вен пищевода и желудка - одна из главных причин гибели больных данной патологией. Сложность патофизиологических изменений в организме, связанных с гемодинамическими нарушениями при портальной гипертензии, до настоящего времени не позволяет окончательно однозначно решить вопросы профилактики и лечения этого грозного осложнения, что делает проблему трудноразрешимой.
В настоящем пособии представлены современные сведения о патогенезе кровотечений из гастроэзофагеальных варикозов у пациентов с циррозом печени, освещены вопросы их профилактики и лечения. Хочется надеяться, что полученная информация поможет врачам общей практики при оказании помощи данной категории больных.
Автор
АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ КРОВООБРАЩЕНИЯ ПЕЧЕНИ
Хирургическая анатомия сосудов печени
Печень кровоснабжается из двух источников: воротной вены, несущей кровь от всех непарных органов брюшной полости, и общей печеночной артерии.
Воротная
вена образуется позади головки поджелудочной железы на уровне II поясничного позвонка, как
правило,
в результате слияния
верхней брыжеечной и селезеночной вен, имеет диаметр 1,5-1,8 см, длину
от 2,8
до 12 см. Иногда в ее формировании принимает участие нижняя брыжеечная
вена.
Кроме того, в основной ствол воротной вены впадают верхняя
панкреатодуоденальная и левая желудочная вены, хотя нередко последняя
несет
кровь в селезеночную вену (рис. 1).
|
|
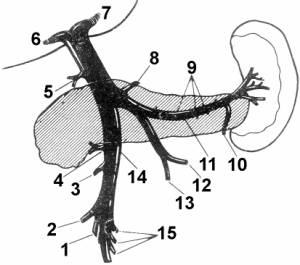
Рис. 1. Притоки воротной вены (по Dauglass) 1 –
подвздошноободочная
вена; 2 – правая ободочная вена; 3 – правая
желудочносаль-никовая вена; 4 – нижняя панкреатодуо-денальная
вена; 5 – верхняя панкреатодуо-денальная вена; 6 –
правая ветвь воротной вены; 7 – левая ветвь воротной вены; 8
– ле-вая желудочная вена; 9 – вены поджелудоч-ной
железы; 10 – левая желудочносальни-ковая вена; 11 –
селезеночная вена; 12 – нижняя брыжеечная вена; 13
– верхняя пря-мокишечная вена; 14 – верхняя
брыжеечная вена; 15 – кишечные вены |
Направляясь
вверх и вправо, она располагается между двумя брюшинными листками
печеночно-двенадцатиперстной связки, позади собственно печеночной
артерии и
общего желчного протока, и проникает в ворота печени, где делится на
два, а
иногда на три ствола, проходящих в паренхиме правой и левой долей
печени.
Воротная
вена связана многочисленными анастомозами с полыми венами
(портокавальные анастомозы).
Они расположены в зоне гастроэзофагеального соединения, на передней
брюшной
стенке, в области прямой кишки, а также между корнями вен портальной
системы
(верхней и нижней брыжеечных, селезеночной и др.) и венами забрюшинного
пространства (почечными, надпочечниковыми, венами яичка или яичника и
др.). Они
играют важную роль в развитии коллатерального кровообращения при
портальной гипертензии
(рис. 2).
|
|
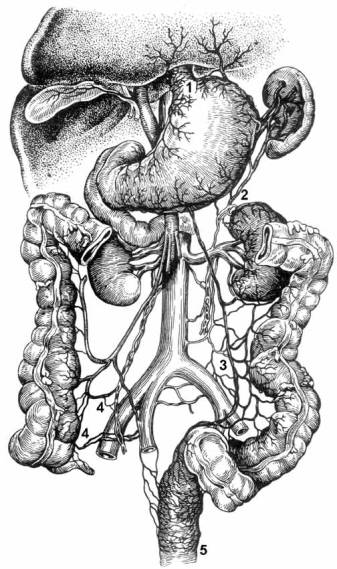
Рис. 2. Портокавальные анастомозы (по А. Н. Максименкову) 1 –
анастомозы между венами
желудка (портальная система) и венами пище-вода (кавальная система); 2 – анасто-мозы
между левой
желудочносальни-ковой веной и левой надпочечниковой веной; 3 – анастомозы между
нижней
брыжеечной веной и поясничными венами; 4 – анастомозы между
правой
яичковой веной и подвздошноободоч-ной веной; 5 – анастомозы между
ниж-ней брыжеечной веной (верхней пря-мокишечной веной) и средней
прямо-кишечной веной |
Количество
печеночных вен сильно варьируется, достигая 25. Однако в большинстве
случаев их
три: правая, средняя и левая. Правая печеночная вена принимает кровь из
правой
доли печени, средняя ‑ из правой, квадратной и
хвостатой долей, а левая –
дренирует
левую и частично квадратную долю. Впадают они в нижнюю полую вену на
5-10 мм
ниже места прохождения последней через отверстие в сухожильной части
диафрагмы
в грудную полость.
Общая
печеночная артерия отходит от чревного ствола и, располагаясь вдоль
верхнего
края поджелудочной железы и правой внутренней ножки диафрагмы ниже
хвостатой
доли печени, доходит до печеночно-двенадцатиперстной связки. Ее длина
составляет
3-4 см, диаметр - 0,5-0,8 см. Непосредственно над привратником, в 1-2
см от
общего желчного протока, она делится на желудочнодвенадцатиперстную и
собственную
печеночную артерии. От последней в начальном отделе начинает свой путь
правая
желудочная артерия, а в пределах ворот печени она делится на правую и
левую
ветви. Длина собственной печёночной артерии колеблется от 0,5 до 3 см,
а
диаметр ‑ от 0,3 до 0,6 см (рис. 3).
|
|
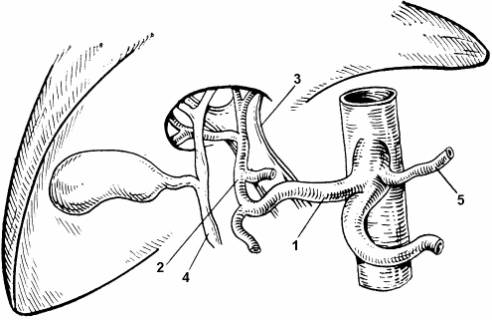
Рис. 3. Схема артериального кровоснабжения печени 1 – общая пече-ночная артерия; 2 – собственная печёночная арте-рия; 3 – воротная вена; 4 – гепатикохоледох; 5 – левая желудочная артерия. |
Морфология печени
В 1833
году F. Kiernan ввел
понятие о дольках печени как основе ее архитектоники. Он описал четко
очерченные дольки пирамидальной формы, состоящие из находящейся в
центре
печеночной венулы (центральной вены) и периферически расположенных
портальных
трактов, содержащих желчный проток, ветви воротной вены и печеночной
артерии.
Между этими двумя системами располагаются балки гепатоцитов и
содержащие кровь
синусоиды (рис. 4).
|
|
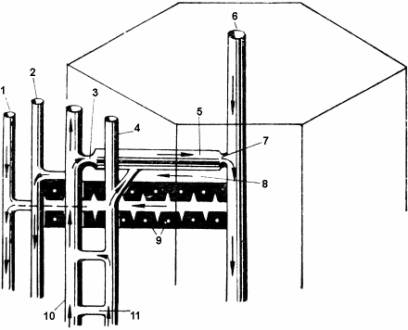
Рис. 4. Схематическое изображение дольки печени (по Kiernan) 1 ‑ желчный
проток; 2 – лимфатический
проток; 3 –
пресинусоидальный
сфинктер; 4 – печёночная
артериола; 5 – синусоид; 6 – центральная
вена; 7 –
постсинусоидальный
сфинктер; 8 –
перисинусоидальное
пространство; 9 – печёночные
клетки; 10 – портальная
венула; 11 –
артериопортальный
анастомоз. |
Ткань
печени пронизана двумя системами каналов ‑ портальными
трактами и
печеночными центральными каналами, которые не соприкасаются между
собой. Они
проходят перпендикулярно друг другу, и расстояние между ними составляет
0,5 мм.
Синусоиды распределены неравномерно и обычно локализуются
перпендикулярно
линии, соединяющей центральные вены. Кровь из терминальных ветвей
воротной вены
попадает в синусоды; при этом направление кровотока определяется
градиентом
давления между воротной и центральной венами.
Анатомическое
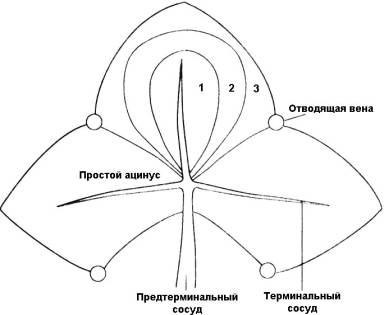
деление печени проводят по функциональному принципу. A. M. Rappaport (1976)
предложил выделять ацинусы, в центре каждого из которых лежит
портальный тракт
с терминальными ветвями воротной вены, печеночной артерии и желчного
протока – зона 1. Ацинусы
расположены веерообразно, в основном
перпендикулярно по отношению к терминальным печеночным венам соседних
синусоидов. Периферические, хуже кровоснабжаемые отделы ацинусов,
прилежащие к
терминальным печеночным венам (зона 3), наиболее страдают от
повреждения (рис.
5).
|
|
Рис. 5. Функциональный ацинус (по Rappaport). Зона 1 примыкает к входной
(портальной) системе. Зона 3 примыкает к выводящей (пече-ночной)
системе. |
Гепатоциты
составляют около 60% массы печени. Они имеют полигональную форму и
диаметр, равный
приблизительно 30 мкм. Это одноядерные, реже многоядерные клетки,
которые
делятся путем митоза. Гепатоцит граничит с синусоидом и пространством
Диссе, с
желчным канальцем и соседними гепатоцитами. Базальной мембраны у них
нет.
Синусоиды
являются структурным компонентом микроциркуляторного русла печени.
Интенсивность гематотканевого обмена в значительной степени зависит от
скорости
кровотока в синусоидах, что в свою очередь связано с особенностями их
строения.
Описаны прямые, ветвящиеся и анастомозирующие типы синусоидов. В их
стенке
помимо выстилающих эндотелиальных клеток различают клетки Купфера,
звездчатые и
ямочные клетки. Синусоидальные клетки вместе с обращёнными в просвет
синусоидов
участками гепатоцитов образуют функциональную и гистологическую единицу.
Стенку
синусоидов образуют эндотелиальные клетки. Их фенестрированные участки
(фенестры) имеют диаметр от 0,1 до 3 мкм и образуют ситовидные
пластинки, которые
служат биологическим фильтром между синусоидальной кровью и плазмой,
заполняющей
пространство Диссе. Можно считать, что фенестры ‑ это не
пассивные
щели, а динамические образования, участвующие в регуляции
гематотканевого обмена
печени, на размер которых влияют портальное давление, острый стресс, а
также
растворимые вещества, такие как алкоголь, серотонин, эндотоксин,
никотин и др.
Эти «печеночные сита» фильтруют макромолекулы
различного размера.
Синусоидальные эндотелиальные клетки с помощью
рецепторно-опосредованного
эндоцитоза активно удаляют из кровообращения макромолекулы и мелкие
частицы, в
том числе ферменты, поврежденные ткани, патогенные факторы, разрушенный
коллаген, а также связывают и поглощают липопротеины.
Клетки
Купфера ‑ это очень подвижные макрофаги, связанные с
эндотелием. Они
фагоцитируют крупные частицы и содержат вакуоли и лизосомы. Клетки
Купфера активируются
при генерализованных инфекциях или травмах. Они специфически поглощают
эндотоксин и в ответ вырабатывают ряд факторов, например
туморнекротизирующий
фактор, интерлейкины, коллагеназу, лизосомальные гидролазы, а также
метаболиты
арахидоновой кислоты, в том числе простагландины.
Звездчатые
клетки печени (липоциты, клетки Ито) составляют 5-8% всех клеток
человека и 13%
объема синусоидальных клеток. Они локализуются в перисинусоидальном
пространстве Диссе под эндотелиальным барьером и имеют длинные
цитоплазматические отростки, которые идут параллельно синусоидальной
эндотелиальной стенке. Второй порядок ветвей, отходящих от отростков,
охватывает синусоид и проникает между гепатоцитами, находящихся рядом с
синусоидами.
В
нормальной печени звездчатые клетки печени главным образом вовлечены в
хранение
витамина А. Вдобавок они синтезируют компоненты внеклеточного матрикса,
матриксразрушающие металлопротеиназы, цитокины и факторы роста.
Вследствие острого
и хронического повреждения печени, клетки Ито активируются и
вовлекаются в процесс
трансдифференциации, ведущий к миофибробластическому фенотипированию.
Более
того, в ответвленных отростках активированных клеток Ито присутствуют a-актин и
филаменты
десмина гладкой мускулатуры, тройная пространственная структура и
некоторые
ультраструктурные характеристики которых схожи с перицитами,
регулирующими кровоток
в других органах. Следовательно, считается, что звездчатые клетки
выполняют функцию
перицитов в печёночных синусоидах.
Ямочные
клетки – это очень подвижные лимфоциты, являющиеся
естественными киллерами. Они
прикреплены к обращенной в просвет синусоида поверхности эндотелия. Их
микроворсинки, или псевдоподии, проникают сквозь эндотелиальную
выстилку, соединяясь
с микроворсинками паренхиматозных клеток в пространстве Диссе. Ямочные
клетки
живут недолго и обновляются за счет лимфоцитов циркулирующей крови,
дифференцирующихся
в синусоидах.
Особенности перфузии печени
Определяющими
параметрами печеночной перфузии считаются величины портального и
артериального
печеночного кровотока, портального сосудистого сопротивления,
портального
давления и градиента давления между воротной и нижней полой веной
(портопеченочный градиент). Постоянство печеночной перфузии
контролируется внутренними
и внешними факторами.
Портальный
кровоток встречает на своем пути две капиллярные системы и поэтому
зависит от сопротивления
в сосудах кишечника и синусоидах печени.
С
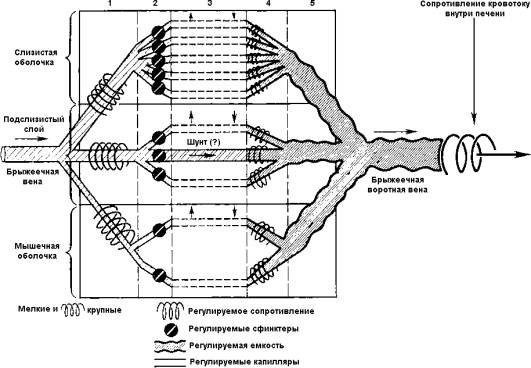
функциональной точки зрения область кишечного кровообращения можно
рассматривать
как состоящую из ряда параллельно и последовательно соединенных
сосудистых
сегментов (рис. 6). Параллельные сегменты снабжают различные слои
кишечной
стенки. Каждая параллельная сеть сосудов состоит из нескольких разных,
анатомически
и функционально, последовательно связанных сосудистых участков.
Прекапиллярные
резистивные сосуды включают обладающие мышечным слоем артериолы и
метартериолы.
Эти сосуды являются основными детерминантами кровотока на отдельном
участке и в
то же время – объектом действия местной и дистантной
систем регуляции,
которые посредством изменения тонуса гладких мышц сосудов осуществляют
постоянный контроль скорости кровотока. Прекапиллярные сфинктеры
представляют
собой особую часть мельчайших прекапиллярных резистивных сосудов.
Сфинктеры
обычно играют небольшую роль в общем регионарном сосудистом
сопротивлении,
однако они имеют первостепенное значение в регуляции количества
перфузируемых
капилляров и, следовательно, определяют среднее расстояние диффузии
между кровью
и тканями, а также время, необходимое для транскапиллярного обмена.
|
|
|
Рис. 6. Схема микроциркуляции кишечника (по Folkow) 1 –
прекапиллярные
резистивные сосуды; 2 – прекапиллярные
сфинктеры; 3 – обменные сосуды;
4 – посткапиллярные
резистивные сосуды; 5 – емкостные сосуды. |
Капилляры,
или обменные сосуды, представляют собой основную часть любого
сосудистого
русла. Через их тонкую эндотелиальную стенку происходит обмен между
внутри- и
внесосудистыми пространствами, что имеет решающее значение для
жизнедеятельности
организма. Непосредственно дистальнее капилляров расположены венулы и
вены,
оказывающие сопротивление потоку и называемые поэтому посткапиллярными
резистивными
сосудами. Тонус этой части сосудистого русла является одной из основных
детерминант
среднего гидростатического капиллярного давления и скорости обмена
жидкости
через капиллярную стенку. Изолированное сокращение этих сосудов, в
частности,
увеличивает гидростатическое давление в проксимальном отделе, приводя
тем самым
к фильтрации жидкости из капилляров в интерстициальную ткань.
Посткапиллярные
резистивные сосуды анатомически переходят в емкостные сосуды,
формирующие
вместе с предыдущим отделом венозный раздел сосудистого русла.
Изменение тонуса
гладких мышц этих сосудов может приводить к значительному сдвигу в
регионарном
объеме крови без существенных колебаний общего регионарного сосудистого
сопротивления.
Кровоток
в кишечнике человека составляет примерно 20-40 мл/мин на 100 г ткани, а
градиент давления на уровне капиллярного русла ‑ 90-100 мм рт.
ст.
Повышение внутрибрюшного давления, физическая нагрузка уменьшают
висцеральный
кровоток. Напротив, прием пищи, особенно жирной, в результате местного
действия
аденозина, матаболита АТФ, а также поступления в воротную циркуляцию
вазоактивных веществ, таких как глюкагон, секретин, холецистокинин,
желчные
кислоты и др., способствует спланхническому полнокровию.
Вместе
с тем это не приводит к существенному увеличению портального притока
вследствие
компенсаторного уменьшения кровотока по селезеночной вене, что связано
с
наличием комплекса внутриорганных рефлекторных путей, посредством
которых осуществляются
изменения внутриселезеночного сосудистого тонуса и микрососудистого
давления.
Кроме того, постоянство портального кровотока при спланхническом
полнокровии в
физиологических условиях объясняется увеличением внутриселезеночной
транссудации жидкости и лимфатического оттока из селезенки.
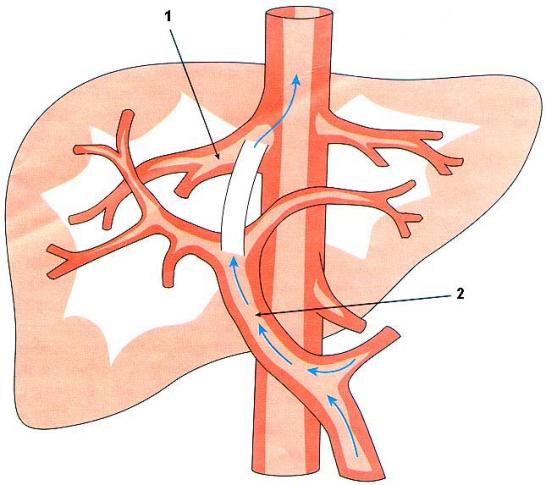
Внутрипеченочная
сосудистая сеть состоит из портальных венул, печеночных артериол,
лимфатических
сосудов, печеночных синусоидов и центральных вен (рис. 7).
|
|
Рис. 7. Схема микроциркуляции печени (по Elias-Sterrick) 1 –
сфинктер в месте
впадения центральной вены в поддольковую вену; 2 –
постсинусоидальный
сфинктер; 3 – выпячивающаяся в
просвет синусоида клетка Купфера; 4 –
артериальный сфинктер; 5 –
пресинусоидальный
сфинктер; 6 – поддольковая
вена; 7 – центральная
вена; 8 – синусоид; 9 – портальная
венула; 10 – печеночная
артериола; 11 ‑ артериальный сфинктер. |
Большая
часть крови поступает в синусоиды из портальных венул через
пресинусоидальные
сфинктеры. Ветви печеночных артериол оканчиваются в начальных отделах
синусоидов. Последние дренируют свою кровь в центральные вены через
постсинусоидальные
сфинктеры, регулирующие портальное сосудистое сопротивление.
В норме печеночный кровоток у взрослых составляет около 1500 мл/мин, или 25-30% сердечного выброса. При этом 25-30% его обеспечивается печеночной артерией и 70-75% - воротной веной. Потребность печени в кислороде на 45-50% удовлетворяет печеночная артерия, оставшиеся 50-55% ‑ воротная вена.
Давление
в печеночной
артерии
равно системному артериальному давлению, в то время как величина
портального
давления, как правило, не превышает 10 мм рт. ст. при портопечёночном
градиенте
давления около 7 мм рт. ст.
В
соответствии с законом Ома портальное венозное давление пропорционально
кровотоку и сопротивлению:
DR = Q x R , где DR - разница
портального
давления вдоль сосуда, Q
– кровоток в системе воротной вены, R –
сопротивление кровотоку.
Так
называемый "артериальный буферный ответ" обеспечивает равновесие
между портальной и артериальной печеночной циркуляцией. Различные
патологические состояния (ишемия, гипоксия, стресс и др.) запускают ряд
нейрогуморальных механизмов, отвечающих за постоянство перфузии печени.
Норадреналин, стимуляция печеночных симпатических нервов, повышая
сопротивление
в области пресинусоидальных сфинктеров портальных венул, и эндотелин-1
(ЭТ-1),
вызывая сокращение непосредственно звездчатых клеток, значительно
увеличивают
портальное сосудистое сопротивление. Местно действующий вазодилататор -
оксид
азота (NO)
- его
уменьшает.
ЭТ-1 является одним из сильнодействующих и наиболее изученных вазоконстрикторов. Эндотелины – семейство, включающее по меньшей мере четыре пептида со сходной химической структурой (ЭТ-1, ЭТ-2, ЭТ-3, ЭТ-4), состоящих из 21 аминокислотного остатка. На мембранах клеток различных органов и тканей располагаются специфические рецепторы, обладающие высоким сродством к эндотелинам. В настоящее время наиболее хорошо изучены эндотелиновые рецепторы типов А и В (ЭТа и ЭТв соответственно). Рецепторы ЭТа находятся преимущественно в гладкомышечных клетках и вызывают вазоконстрикцию, тогда как рецепторы ЭТв представлены в различных клетках и имеют несколько биологических эффектов. Рецептор ЭТв1 индуцирует NO синтазу эндотелиальных клеток (eNOS), что приводит к выделению NO и вазодилятации, в то время как рецептор ЭТв2 вызывает вазоконстрикцию. Рецепторы ЭТа и ЭТв выявлены в звездчатых клетках печени и гепатоцитах, рецептор ЭТв – только в клетках Купфера и эндотелиальных клетках синусоидов. По сравнению с нормальной печенью содержание обоих типов эндотелиальных рецепторов увеличивается при циррозе. Активированные звездчатые клетки печени являются главным местом синтеза ЭТ-1, более того, в это время их чувствительность к ЭТ-1 повышается, что объясняется паракринным и аутокринным влиянием последнего. В ранние фазы активации звездчатых клеток печени рецепторы ЭТа являются ведущими, но в дальнейшем более значимыми становятся рецепторы ЭТв. Это важно, т.к. стимуляция первых приводит к сокращению и пролиферации клеток Ито, тогда как возбуждение рецепторов ЭТв ‑ к их антипролиферативной активности и расслаблению.
NO продуцируется из L-аргинина тремя изоформами NO-синтазы (NOS). Самые различные клетки, включая гладкомышечные клетки сосудов, гепатоциты, звёздчатые клетки печени, выделяют индуцибельную форму NOS (iNOS), тогда как эндотелиальные клетки (eNOS) и нейрональные клетки (nNOS) – конститутивные формы NOS. Некоторые факторы роста, например, трансформирующий фактор роста-b, сосудистый эндотелиальный фактор роста, повышают экспрессию eNOS, в то время как туморнекротизирующий фактор-a ее снижает. iNOS модулируется различными стимулами, включая цитокины и липополисахариды.
NO функционирует в биосистемах как высокоэффективный регулятор метаболизма. Диапазон проявлений его биологической активности огромен. Он участвует в регуляции кровотока и иммунитета, в нейротрансмиссии и защите организма от бактериального поражения. NO повышает уровень цГМФ, способствуя снижению концентрации Ca2+ , что делает его потенциальным вазодилататором.
Кроме
ЭТ-1 и NO, влиять на печеночный
кровоток за
счет изменения
тонуса звездчатых клеток печени способны и другие вазоактивные
вещества,
основные из них представлены в табл. 1.
Таблица
1. Вазоактивные вещества, способные влиять на тонус звездчатых клеток
|
Вещества,
вызывающие сокращение
звездчатых клеток печени |
Вещества,
вызывающие расслабление
звездчатых клеток печени |
|
Тромбоксан
А2 Простагландин F2a Лейкотриен D4 Антидиуретический гормон
(вазопрессин) Тромбин Ангиотензин II Субстанция P Лизофосфатная кислота |
Соматостатин Предсердный натрийуретический фактор Адреномедуллин Сосудистый эндотелиальный фактор роста Илопрост Простагландин I2 (простациклин) Простагландин E2 Липополисахариды
Интерферон-g |
ПАТОГЕНЕЗ КРОВОТЕЧЕНИЙ ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА И ЖЕЛУДКА У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ
Патогенез портальной гипертензии при циррозе печени
Портальная гипертензия обычно развивается в результате препятствия кровотоку на любом участке воротной вены. A.O. Whipple в 50-е годы прошлого столетия предложил деление ее на внутрипеченочный и внепеченочный типы. В настоящее время различают пресинусоидальную (внепеченочную или внутрипеченочную) и собственно внутрипеченочную портальную гипертензию (табл. 2).
Таблица
2. Классификация портальной гипертензии
Пресинусоидальная
Внепеченочная Внутрипеченочная Печеночная
Внутрипеченочная Постсинусоидальная |
Блокада воротной вены Увеличение кровотока через селезенку Инфильтрация портальной зоны Токсическая Печеночно-портальный склероз Цирроз Другие заболевания, сопровождающиеся образованием узлов Блокада на уровне печеночных вен |
Существует две теории патогенеза портальной гипертензии при циррозе печени (рис. 8). Основой одной из них (backward flow) является увеличение печеночного сосудистого сопротивления, преимущественно на уровне синусоидов. Факторы, повышающие резистентность, делятся на статические, связанные с фиброзом и формированием узлов регенерации, которые нарушают архитектуру печени, и обратимые ‑ в результате изменений метаболизма местно действующих вазоактивных веществ, таких как NO, ЭТ-1, норадреналин, ангиотензин, тромбоксан А2 , фактор, активирующий тромбоциты, лейкотриены и других. При этом активность NOS в цирротически измененной печени уменьшается, а уровень ЭТ-1 увеличивается.
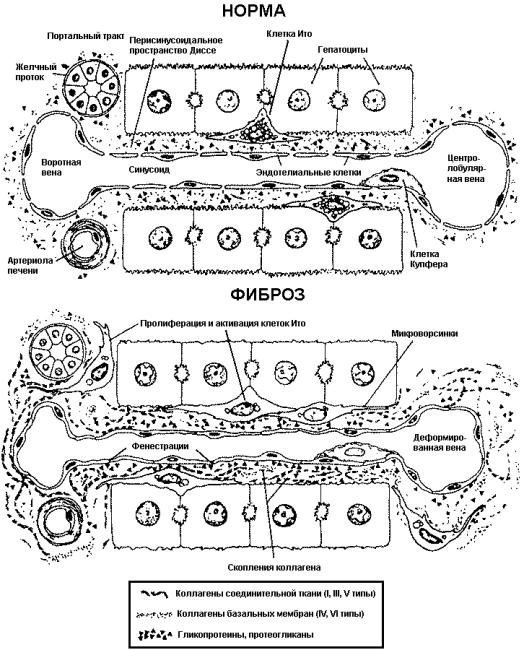
В настоящее время цирроз печени принято рассматривать как финальную, необратимую стадию хронического гепатита с неблагоприятным прогнозом. В его этиологии основную роль играют вирусы гепатитов В, С, а также алкоголь и другие токсические вещества. Длительное их нахождение в организме сенсибилизирует макрофаги печени и эндотелий синусоидов к вторичным индукторам воспаления, прежде всего к эндотоксину грамотрицательной микрофлоры, давая толчок к хронизации процесса. Источником эндотоксемии, как правило, является кишечник. Считается, что эндотоксины представляют нормальную составляющую портальной крови.
Поврежденные гепатоциты продуцируют реактивные виды кислорода; сенсибилизированные макрофаги - флогогенные цитокины (интерлейкины-1, -6, -8, туморнекроти-
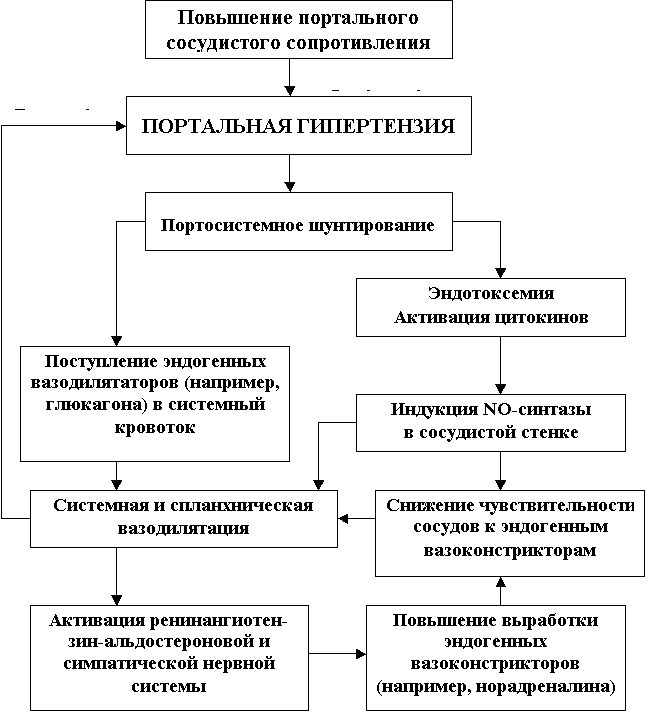
Рис. 8. Потенциальные механизмы патогенеза портальной гипертензии.
зирующий фактор-a), хемокины, фактор, активирующий тромбоциты; эндотелиальные клетки - NO, ЭТ-1, при участии которых как на поверхности гепатоцитов, так и синусоидальных клеток происходит адгезия нейтрофилов с формированием в околососудистых пространствах мононуклеарных инфильтратов. В период своей активности последние капилляризируются и прорастают соединительной тканью, в чем ключевую роль играют фибробласты, предшественниками которых в печени являются клетки Ито или липоциты. Под влиянием ростовых цитокинов (тромбоцитарного фактора роста, трансформирующего фактора роста-b1), выделяемых мононуклеарами, стимулируется их фиброгенная активность, что ведет к гиперпродукции соединительной ткани в зоне мононуклеарного инфильтрата.
|
|
|
Рис.
9. Изменения клеток печени и внеклеточного матрикса при фиброзе печени |
В нормальных условиях субэндотелиальное пространство Диссе содержит компоненты базальной мембраны синусоидов. В отличие от мембран других сосудов она имеет низкую плотность, создавая эффект «фенестрации» эндотелия, что позволяет осуществлять обмен веществ между гепатоцитами и кровью синусоидов. В процессе фиброгенеза накопление фибриллообразующих коллагенов I, III и IV типов в пространстве Диссе приводит к его «капилляризации» и нарушению микроциркуляции печени (рис. 9). Эти изменения являются основой развития портальной гипертензии.
Таким
образом, как диффузный фиброз и сформировавшиеся узлы регенерации,
так и нарушение метаболизма местно действующих вазоактивных веществ,
вырабатываемых
синусоидальными клетками, способствуют повышению портального
сосудистого сопротивления.
Как следствие, предсуществующие коллатеральные вены расширяются,
формируя
портокавальные шунты.
Вместе
с тем нормализация портального давления не наступает. Напротив,
наблюдается гипердинамическое состояние внутриорганного кровотока,
сопровождающееся увеличением сердечного выброса и уменьшением
периферического
сосудистого сопротивления, что приводит к хронизации портальной
гипертензии
(теория forward flow).
Спланхническое полнокровие вследствие вазодилятации и внутриорганного венозного застоя снижает эффективный объем крови. Развивается тенденция к артериальной гипотонии, что вызывает активацию ренин-ангиотензинальдостероновой и симпатической нервной систем, высвобождение натрийуретического фактора, повышение выработки норадреналина, ЭТ-1. Однако, как показали исследования, чувствительность сосудов к циркулирующим эндогенным вазоконстрикторам при портальной гипертензии значительно снижена.
Причиной гипердинамического состояния внутриорганного кровотока могут быть поступающие через сеть естественных портокавальных шунтов сосудорасширяющие вещества, такие как глюкагон, адреномедулин, простагландины, аденозин, желчные кислоты и другие, а также бактериальный липолисахарид, обычно устраняемый печенью.
Действительно, эндотоксемия при циррозе прямо или опосредованно через цитокиновый каскад стимулирует NOS эндотелия сосудов, увеличивая продукцию NO. В частности, гиперактивность NOS при портальной гипертензии отмечена в аорте и верхней брыжеечной артерии.
Установлено,
что у больных циррозом печени с эндотоксемией повышено содержание
нитритов и
нитратов как в плазме, так и моче. Кроме того, предполагается, что
вследствие
избыточной продукции NO
уменьшается активность протеинкиназы С. Это
обстоятельство способствует снижению чувствительности сосудов к
циркулирующим вазоконстрикторам.
Следует отметить, что анемия вследствие кровопотери усугубляет нарушения гемодинамики, характерные для цирроза печени.
Механизм формирования пищеводно-желудочных варикозов
В
области гастроэзофагеального соединения связь между
портальным и системным кровообращением осуществляется преимущественно
через левую
желудочную и так называемые коронарную и заднюю желудочную вены и представляется
чрезвычайно
сложной.
Левая желудочная вена, дренируя обе желудочные поверхности, восходит по малой кривизне влево в малый сальник к пищеводному отверстию диафрагмы, где сообщается с венами пищевода. Затем, изгибаясь обратно вниз и вправо позади сальниковой сумки, впадает в воротную вену. При портальной гипертензии реверсия кровотока в ее системе может влиять на кровенаполнение и формирование пищеводных варикозов.
Под терминами “коронарная вена” и “задняя желудочная вена” подразумевают соответственно анастомозы между левой и правой желудочными венами и левой и короткими желудочными венами. В норме они не выражены и имеют клиническое значение при гемодинамических нарушениях, характерных для цирроза печени, способствуя развитию желудочных варикозов.
Между пищеводом и желудком выделяют четыре сосудистые зоны. При портальной гипертензии они играют роль естественных портокавальных шунтов и обозначены как желудочная, палисадная, перфорирующая и стволовая зоны (рис. 10).
1. Желудочная зона. Ее вены локализуются в собственной пластинке слизистой оболочки и подслизистой основе проксимального отдела желудка и расположены продольно. Ближе к пищеводу они более многочисленны, имеют малый диаметр и образуют группы из нескольких небольших продольных сосудов. В дистальной же части желудочной зоны вены в подслизистом слое сливаются, формируя большие извилистые стволы, дренирующиеся в сосуды системы воротной вены.
2. Палисадная зона является продолжением желудочной зоны. Она начинается в проекции гастроэзофагеального соединения и простирается на 2-3 см выше него. Вены здесь расположены беспорядочно, в непосредственной близости друг от друга и проходят параллельно и продольно, как палисадник.
|
|
Рис. 10. Сосудистая структура гастроэзофагеального соединения при портальной гипертензии 1 –
желудочная зона; 2 – палисадная зона;
3 – перфорирующая
зона; 4 – стволовая зона. |
Выявлены многочисленные анастомозы как между ними, так и между сосудами желудочной зоны. В области гастроэзофагеального соединения они, локализуясь в подслизистой основе, пронизывают мышечную пластинку слизистой оболочки и проходят в собственной пластинке преимущественно в продольном направлении.
В проксимальной части палисадной зоны вены одновременно сходятся в одной точке и, перфорируя мышечную пластинку слизистой оболочки, переходят опять в подслизистую основу в виде четырех или пяти больших стволов. Между ними существуют поперечные дугообразные анастомозы. В этой зоне не обнаружено вен, перфорирующих мышечную оболочку пищевода.
3. Перфорирующая зона. Вены перфорирующей зоны, расположенной на 3-5 см выше гастроэзофагеального соединения, не так однородны и постоянны.
В
собственной пластинке слизистой оболочки пищевода, как продолжение вен
палисадной
зоны, сосуды формируют пять полигональных сетей и перфорируют мышечную
оболочку. На наружной поверхности пищевода они представляют собой
внешние пищеводные
вены и ввиду их сходства с музыкальными символами были обозначены как
вены-
«скрипичные ключи» (англ. treble
clef
veins).
4.
Стволовая
зона определена как область
от 8 до 10 см в длину с нижним краем на 5 см выше гастроэзофагеального
соединения.
Большие продольные венозные стволы, обнаруженные здесь в собственной пластинке, представляют собой продолжение полигональных сосудистых сетей перфорирующей зоны и в проксимальной части имеют небольшой диаметр. Между ними имеют место несколько поперечно ориентированных анастомозов.
Перфоранты, расположенные беспорядочно вдоль этой зоны, проходят из подслизистой основы на внешнюю поверхность пищевода.
Палисадная зона является наиболее важным звеном в сосудистой структуре гастроэзофагеального соединения. Вены здесь главным образом находятся в собственной пластинке, и их поверхностное расположение снижает до минимума сопротивление венозному кровотоку, которое в противном случае возникло бы в зоне высокого давления в области нижнего пищеводного сфинктера.
Большое количество сосудов мелкого калибра в палисадной зоне, имеющих продольный ход параллельно друг другу, идеально приспособлены к физиологическим колебаниям давления при дыхании, которые приводят к двунаправленности циркуляции. Когда венозный отток происходит в каудальном направлении, желудочная зона собирает и дренирует кровь в систему воротной вены.
В случае оттока в краниальном направлении венозные стволы и многочисленные вены, прободающие мышечную оболочку пищевода (вены-«скрипичные ключи») в перфорирующей зоне, посылают кровоток кнаружи от просвета пищевода, преимущественно в непарную вену.
Известно,
что портопеченочный градиент давления у больных циррозом печени
определяется
двумя факторами:
1)портальным сосудистым сопротивлением;
2)резистентностью в коллатеральной сети.
Исследования
показали, что его увеличение до 12 мм рт. ст.
способствует формированию пищеводно-желудочных варикозов. Однако
примерно у 50%
пациентов он отсутствует и лишь у 9-36% достигает больших размеров. Это
связано
с наличием различных путей гепатофугального кровотока, которые могут
развиваться
при портальной гипертензии, и гастроэзофагеальное соединение является
только одним
из них.
Наиболее крупные варикозы, как правило, локализуются в 2-3 см выше и 2 см ниже кардии. Они располагаются в виде либо палисадника, либо полос, преимущественно поверхностно в собственной пластинке слизистой оболочки. Для первого типа характерны расширенные внутриэпителиальные канальца и мелкие множественные поверхностные вены, для второго - несколько расширенных субэпителиальных поверхностных и глубоких подслизистых вен, перфорирующих эпителий.
Факторы риска и исход кровотечений из варикозно расширенных вен пищевода и желудка
Оценка состояния слизистой оболочки пищевода и желудка у больных циррозом печени имеет важное значение для определения риска гастроэзофагеальных кровотечений. При этом золотым стандартом диагностики является эндоскопия. Для оценки размера варикозно расширенных вен дистальный отдел пищевода необходимо заполнить воздухом, в противном случае размер может быть завышен.
Желудочный варикоз нередко трудно выявить с помощью эндоскопии. Его часто ошибочно принимают за складку слизистой оболочки. Идентифицировать варикоз можно по его форме (вид виноградной грозди) и характерному синеватому оттенку.
Геморрагические
проявления на слизистой оболочке желудка у больных
с портальной гипертензией и все, что с ними связано, являются
неблагоприятными
прогностическими признаками. При этом отмечена прямая зависимость между
тяжестью гастропатии, величиной
портопеченочного градиента
давления, степенью
дисфункции
печени и
обратная – с выраженностью
варикозно расширенных вен
желудка.
По расположению варикоз делится на пищеводный и желудочный. Японским обществом по изучению портальной гипертензии (Japanese Research Society for Portal Hypertension) предлагается следующая классификация степени варикозного расширения вен пищевода:
F1 – небольшой, прямой варикоз;
F2 – извитой варикоз, занимающий менее 1/3 просвета пищевода;
F3 – большой, четкообразный, занимающий более 1/3 просвета пищевода.
Согласно рекомендациям согласительной конференции в Бавено (Baveno Consensus Conference), по локализации варикозное расширение вен желудка подразделяется на:
А. Гастроэзофагеальный варикоз:
1-й тип (GEV1) – вдоль малой кривизны желудка (обычно длиной до 2-5 см)
2-й тип (GEV2) - вдоль большой кривизны с распространением на дно желудка.
В. Изолированный желудочный варикоз:
1-й тип (IGV1) – в области дна желудка
2-й тип (IGV2) – в других отделах желудка.
GEV1 формируется, когда левая желудочная вена, пенетрируя стенку желудка, соединяется с глубокими подслизистыми венами палисадной зоны. Для него обычно характерен пищеводный варикоз F3. Наоборот, при GEV2 последний встречается только в 50% случаев. IGV1 наиболее часто имеет место при сегментарной портальной гипертензии (например, при тромбозе селезеночной вены) или при наличии спонтанных спленоренальных шунтов. Примерно у каждого второго больного эктопический варикоз (включая IGV2) связан с тромбозом воротной вены. Механизм развития этого феномена неясен.
Считается, что ведущим фактором, способствующим разрыву варикозных узлов, является комбинация повышения давления внутри их просвета и слабости стенки сосуда. По закону Лапласа, напряжение сосудистой стенки (T) пропорционально величине внутрисосудистого давления (P), диаметру сосуда (D) и обратно пропорционально толщине его стенки (W):
T = P x D / W
Следует отметить, что неинвазивными прогностическими признаками наличия больших варикозов являются тромбоцитопения, уменьшение соотношения количества тромбоцитов и диаметра селезенки, а также тяжелые нарушения функции печени.
Поверхностное расположение варикозно расширенных вен, их связь с наполненными кровью внутриэпителиальными каналами, которые соответствуют эндоскопическим понятиям “вишнево-красные пятна” или “варикоз на варикозе” (англ. cherry red spots, varices on top of the varices), а также воспалительные изменения слизистых оболочек пищевода и желудка играют существенную роль в разрыве варикозных узлов. При этом не исключается роль ЭТ-1.
На основании эндоскопических находок рассчитан прогностический индекс (PI), позволяющий предсказывать риск кровотечения, включающий в себя три независимых показателя: степень пищеводных (A) и желудочных (B) варикозов, выраженность гастропатии (С):
PI = (A x 0,0395) + (B
x
0,705) + (C x 0,878),
согласно
которому у больных с индексом менее 2,56 вероятность кровотечения 0-20%
в
течение первого года наблюдения. Если же он превышает 4,51, то его
угроза возрастает
до 81-100%.
Помимо
визуальной оценки изменений слизистой оболочки пищевода и желудка,
показателем
риска варикозного кровотечения является расширение параэзофагеальных и
парагастральных вен более 5 мм, выявленное при эндоскопической
ультрасонографии.
Еще одним не менее важным фактором является повышение портопеченочного градиента давления выше 12 мм рт. ст., что во многом зависит от стадии цирроза печени. С другой стороны, его величину нельзя рассматривать статически.
Во-первых,
у больных с портальной гипертензией отмечены
суточные колебания этого показателя: прогрессивное уменьшение от
полудня к
вечеру с минимальными значениями к 19 часам и постепенный подъём в
течение ночи
с достижением исходного уровня к 9 часам.
Во-вторых, увеличение градиента зафиксировано после приема пищи, этанола, при повышении внутрибрюшного давления, например, вследствие асцита.
Очевидно, что у больных с высоким риском развития варикозного кровотечения даже небольшие изменения портального давления могут быть клинически значимыми.
В последние годы благодаря внедрению в исследовательскую и медицинскую практику допплеровской ультрасонографии появилась возможность измерять кровоток в сосудах внутренних органов. Установлено, что индекс застоя (англ. congestion ingex) (CI) системы воротной вены коррелирует с величиной портопеченочного градиента давления и может служить независимым фактором риска варикозного кровотечения.
Он рассчитывается по формуле:
CI = Sвв / Vср. вв ,
где Sвв – площадь поперечного сечения воротной вены, Vср. вв – средняя линейная скорость кровотока в ней.
Летальность от первого варикозного кровотечения колеблется от 30 до 50%. Большинство смертельных исходов встречаются после его раннего рецидива, который развивается в 20-50% случаев уже через 7-10 дней. Многие больные умирают от печеночной недостаточности часто обусловленной массивной кровопотерей. При этом неблагоприятным прогностическим признаком является повышение С-реактивного белка. В отдаленном периоде вероятность кровотечений остается высокой и при отсутствии профилактического лечения составляет 47-84% в среднем за период от 6 месяцев до 2 лет с летальностью 20-80%.
ЛЕЧЕНИЕ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ
Исходя
из
современных представлений о патогенезе портальной гипертензии лечебно-профилактические
мероприятия должны либо
устранять
варикозно
расширенные вены
пищевода и
желудка, либо быть
направлены на снижение портопеченочного
градиента
давления. Достичь последнего можно как за счет
уменьшения
спланхнического
полнокровия, так и редукции печеночного
сосудистого сопротивления. Выбирая метод
лечения,
необходимо учитывать
этиологию
цирроза,
характер портальной гемодинамики,
особенности
коллатерального кровотока, функциональное состояние печени в
соответствии с критериями Child-Pugh
(табл. 3) и
морфологические изменения в
органе.
Таблица 3. Шкала тяжести
заболевания печени
(по Child-Pugh)
|
Клинические и
биохимические показатели |
Шкала-оценка степени
отклонения показателей
от нормы |
||
|
1 |
2 |
3 |
|
|
Асцит |
Нет |
Контролируемый |
Резистентный |
|
Энцефалопатия |
Нет |
Прекома 1-2 |
Кома |
|
Билирубин (мкмоль/л) |
17-34 |
34-51 |
> 51 |
|
Билирубин при ПБЦ
(мкмоль/л) |
17-68 |
68-170 |
> 170 |
|
Альбумин (г/л |
> 35 |
28-35 |
< 28 |
|
ПТИ (в %) |
80-100 |
79-60 |
< 60 |
|
1. Child A: 5-6 баллов (низкий операционный риск) 2. Child B: 7-9 баллов (средний операционный риск) 3. Child C: 10-15 баллов (высокий операционный риск) |
|||
Фармакотерапия
В идеале развития портальной
гипертензии можно избежать, например, путем воздействия на процесс
фиброгенеза.
Несмотря на то что этот вопрос интенсивно изучается, говорить о
каких-либо
конкретных клинических результатах еще рано.
На практике препараты, выбранные для фармакотерапии портальной гипертензии, должны либо уменьшать спланхническое полнокровие и, соответственно, портальный кровоток, либо редуцировать печеночное сосудистое сопротивление. Кроме того, риск развития побочных реакций на фоне лечения не должен превышать опасности самого кровотечения. Критерием эффективности проводимой терапии в настоящее время считают снижение портопеченочного градиента давления ниже 12 мм рт. ст., или более чем на 20% от исходного.
Несмотря на то что исследовано
большое количество групп препаратов для профилактики и лечения
варикозных
кровотечений (табл. 4), лишь немногие из них нашли клиническое
применение.
Таблица
4.
Препараты, применяемые для фармакотерапии портальной гипертензии
|
I. Вазопрессин и его аналоги (терлипрессин, десмопрессин, питуитрин II. Органические нитраты (нитроглицерин, изосорбида динитрат, изосорбида-5-мононитрат) III. Адреноблокаторы: 1. Селективные a1-адреноблокаторы (празозин) 2. Селективные b1-адреноблокаторы (бетаксолол) 3. Селективные b2 –адреноблокаторы (тербуталин) 4. Неселективные b-адреноблокаторы (пропранолол, анаприлин, надолол) 5. Неселективные b- и a1-адреноблокаторы (карведилол) IV. Блокаторы серотониновых (S2) рецепторов (кетансерин, ритансерин) V. Соматостатин и его аналоги (октреотид, сандостатин) VI. Центрально действующие агонисты a2-адренорецепторов (клонидин) VII. Диуретики: 1. Петлевые диуретики (фуросемид, буметанид) 2. Антагонисты альдостерона (спиронолактон, канренон) VIII. Блокаторы кальциевых каналов (верапамил, нифедипин, тетрадрил, дилтиазем) IX. Блокаторы рецепторов ангиотензина II (лозартан, ирбесартан) X. Ингибиторы туморнекротизирующего фактора a (талидомид) XI. Прокинетики (метоклопрамид, цисаприд) |
Вазопрессин (антидиуретический гормон) является одним из наиболее изученных лекарственных средств для лечения кровотечений из варикозно расширенных вен пищевода. Он представляет собой пептидный нейрогормон, синтезируемый крупноклеточными ядрами гипоталямуса и депонируемый в гипофизе. При взаимодействии со специфическими V1-рецепторами гладкой мускулатуры артерий, в частности, артериол органов брюшной полости, вазопрессин вызывает их сокращение. Антидиуретический гормон способствует снижению кровотока в воротной вене на 55%, портального давления - на 35%, а портопеченочного градиента давления - не менее чем на 50%, что коррелирует с уменьшением давления в пищеводных варикозах. Вместе с тем отмечено, что на фоне гиповолемии эффективность препарата намного ниже, чем в стабильном состоянии.
Системная вазоконстрикция вследствие назначения вазопрессина нередко сопровождается неблагоприятными гемодинамическими эффектами с увеличением периферического сосудистого сопротивления и уменьшением сердечного выброса, ЧСС и коронарного кровотока. Это может привести к таким серьезным осложнениям, как инфаркт миокарда, нарушения ритма сердца, мезентериальная ишемия, цереброваскулярные расстройства, и другим. Вследствие чего, по данным литературы, в 25% случаев терапия вазопрессином была отменена.
Сочетание нитроглицерина и вазопрессина увеличивает редукцию портального давления, при этом нивелируются побочные эффекты вазопрессина. Нитроглицерин, высвобождая NO, уменьшает печеночное сосудистое сопротивление и улучшает функцию миокарда.
Наличие
нежелательных системных сосудистых реакций вазопрессина способствовало
разработке аналогов, у которых они менее выражены. Одним из них
является терлипрессин
(триглицил-лизин
вазопрессин)
- синтетический полипептид пролонгированного действия, который после
внутривенного введения конвертируется в вазопрессин посредством
ферментативного
распада триглицилового остатка на тканевые пептиды.
Органические нитраты (нитроглицерин, изосорбида динитрат, изосорбида-5-мононитрат), являясь потенциальными вазодилататорами с преимущественным влиянием на венозную систему, действуют на специфические нитратные рецепторы гладкомышечного слоя стенки сосудов, вызывая их расслабление. Исследования показали, что они могут быть использованы как для профилактики, так и лечения кровотечений из варикозно расширенных вен пищевода, при этом без какого-либо побочного влияния на функцию печени. Назначение нитратов в высоких дозировках, вызывающих артериальную гипотонию, способствует редукции портального венозного сопротивления и расширению портосистемных коллатералей вследствие стимуляции барорецепторов высокого давления. Напротив, их низкие дозы снижают портальное давление за счет уменьшения притока крови в систему воротной вены, возникшего в результате рефлекторной спланхнической вазоконстрикции в ответ на венозный застой.
Вместе
с тем органические нитраты могут увеличить уже существующую
периферическую
вазодилатацию при циррозе, вызывая нарушение функции
почек (снижение почечного кровотока и клубочковой фильтрации, задержку
натрия и
воды). Кроме того, развитие толерантности к ним при длительном приеме,
а также
трудность подбора оптимальной дозировки делают вопрос о применении их в
качестве монотерапии портальной гипертензии спорным. Однако
продолжительное лечение изосорбида-5-мононитратом больных
компенсированным
циррозом печени будет безопасным, если оно сочетается с назначением
неселективных b-адреноблокаторов.
Комбинированная терапия не приводит к негативному эффекту на обмен
натрия, т.к.
слабая системная вазоконстрикция и супрессия выделения ренина,
вызванная b-блокадой,
противодействует системному и почечному влиянию
изосорбида-5-мононитрата.
Как известно, нервная регуляция сосудов внутренних органов осуществляется симпатическими нервными волокнами. При этом a-адренергические средства, действуя местно, вызывают вазоконстрикцию, тогда как b-адренергические препараты ‑ дилатацию. Блокада b2-адренорецепторов оказывает неограниченное a-адренергическое влияние, способствуя сужению артериол внутренних органов. Это и, возможно, уменьшение сердечного выброса за счет блокады b1-адренорецепторов являются причиной редукции портального притока. Первым из неселективных b-адреноблокаторов для профилактики кровотечений из варикозно расширенных вен пищевода был применен пропранолол. В настоящее время его влияние на гемодинамику у больных циррозом печени хорошо изучено. Так, блокада b2-адренорецепторов посредством пропранолола приводит к вазоконстрикции, не только в спланхническом артериальном ложе, но также и в портосистемных коллатералях, уменьшая азигальный кровоток и давление в пищеводных варикозах. Неселективные b-адреноблокаторы редуцируют перфузию печени, слизистой оболочки желудка, почек. Несмотря на увеличение активности ренина, дисфункция почек при приеме пропранолола встречается редко.
Исследования показали наличие a1-адренергических рецепторов в гладких мышцах воротной вены, и их стимуляция за счет вазоконстрикции увеличивает сопротивление портальному кровотоку. Празозин относится к антагонистам a1–адренергических рецепторов и широко используется при лечении артериальной гипертензии и застойной сердечной недостаточности. Обнаружено, что у больных циррозом этот препарат, снижая печёночное сосудистое сопротивление, уменьшает портальное давление и улучшает перфузию печени. Вместе с тем продолжительная терапия празозином обусловливает усугубление периферической вазодилатации и может способствовать задержке натрия и воды. Другим потенциальным недостатком длительного применения препарата является развитие истинной толерантности, связанной с уменьшением экспрессии a1–адренергических рецепторов в ответ на артериальную гипотензию.
Карведилол является неселективным b-адреноблокатором с существенной анти-a1–адренергической активностью. Его эффект схож с таковым при комбинированной терапии, включающей пропранолол и празосин. Показано, что кратковременное назначение карведилола у больных циррозом печени вызывает более выраженное уменьшение портального давления, чем при применении пропранолола. При длительном приеме препарата получены аналогичные результаты. Величина снижения портопечёночного градиента давления была на 50% большей, чем при назначении пропранолола. Более того, при использовании карведилола процент больных, у которых были достигнуты заданные значения портопеченочного градиента давления (уменьшения на 20% и более от исходных, или ниже 12 мм рт. ст.), является значительно большим (58%), чем при лечении пропранололом (23%). Эти результаты подтверждают хороший потенциал препарата для лечения портальной гипертензии, по крайней мере у больных с недостаточным ответом на неселективные b-адреноблокаторы. Важно отметить, что в отличие от действия пропранолола снижение портопеченочного градиента давления, индуцированное карведилолом, не сопровождается сопутствующим уменьшением перфузии печени.
При приёме карведилола величина редукции сердечного выброса была меньшей, а снижение портоколлатерального (азигального) кровотока аналогичным таковому при использовании пропранолола, что указывает на более выраженное b1–адренергическое блокирующее действие последнего. При продолжительной терапии влияние карведилола на артериальное давление и системное сосудистое сопротивление является менее выраженным, чем после его кратковременного назначения. Это может быть связано с генерализованным истощением сосудорасширяющего эффекта, описанного у больных циррозом, получавших длительное лечение a1–адренергическим блокатором празозином. Постоянное назначение карведилола не влияет на функцию почек, но вызывает задержку воды и натрия, способствуя увеличению объема циркулирующей плазмы.
Установлено, что при портальной гипертензии сосуды системы воротной вены являются гиперчувствительными к вазоконстрикторному влиянию серотонина, синтезируемого в энтерохромаффинных клетках, главным образом кишечника, и действующего через S2–рецепторы. Ритансерин является специфическим и селективным антагонистом S2–рецепторов, лишенным системного влияния. Он редуцирует портальное давление посредством уменьшения печеночного сосудистого сопротивления, не вызывая изменений в системной гемодинамике. Использование его в комбинации с пропранололом усиливает этот позитивный эффект.
В
физиологических условиях гормон поджелудочной железы глюкагон оказывает
сосудорасширяющее действие, а при циррозе печени избирательно
индуцирует
спланхническую вазодилатацию. Соматостатин, ингибируя
его сосудорасширяющее влияние, а также подавляя индуцированное ЭТ-1
сокращение
синусоидов печени, способен увеличивать сопротивление сосудов
внутренних
органов, эффективно снижать портальное давление и портоколлатеральный
(азигальный) кровоток с умеренным уменьшением печёночной перфузии. Эти
данные
послужили основанием для применения соматостатина, а в последние годы
его синтетического
аналога сандостатина
(октреотида),
у
больных с кровотечениями из варикозно расширенных вен пищевода.
Установлено,
что он столь же эффективен, как и терлипрессин, и сочетание последнего
с
нитроглицерином, при меньшей частоте осложнений. Однако длительное
применение
сандостатина вызывает гипочувствительность к его действию, что
отражается на
результатах лечения.
Эндоскопические методы
Инъекционная
склеротерапия варикозно расширенных вен пищевода впервые в клинике была
применена
в 1936 году и описана C. Crafoord и P. Frenckner в 1939 году. Этот
метод
длительное время оставался
непризнанным, и лишь в 60-х годах прошлого столетия с внедрением в
практику
гибких эндоскопов получил дальнейшее развитие.
Техника инъекционной склеротерапии может быть двоякой. В одном случае склерозирующее вещество вводится непосредственно в расширенные вены (1-3% р-р тромбовара, 5% р-р этаноламина олеата, 5% р-р морруата натрия, 1,5-3% р-р тетрадецила сульфата натрия), облитерируя их просвет, в другом ‑ параварикозно (1% р-р полидоканола (этоксисклерола)) с целью продукции фиброзного слоя, перекрывающего просвет сосуда. На практике эти две методики трудно отделить одну от другой и выполнить в “чистом виде”. При интраварикозной технике часто происходит «утечка» склерозанта в подслизистый слой, что ведет к периваскулярному фиброзу, тогда как воспалительный ответ, возникающий при обкалывании варикозного узла, может способствовать его тромбозу и окклюзии. Введение склерозанта ограничивается преимущественно 2-3 см области гастроэзофагального соединения.
Различают ранние (в течение первых 24 часов после инъекции) и поздние (через несколько дней или недель) осложнения эндоскопической склеротерапии (табл. 5). Она может быть причиной развития гастропатии. Умеренное преходящее нарушение моторики пищевода при наличии варикоза наблюдается часто, однако стойкая дисфагия, как правило, связана с формированием рубцовых стриктур, риск развития которых зависит от числа инъекций и количества введенного склерозанта. Язвы слизистой оболочки пищевода - серьезное позднее осложнение эндоскопической склеротерапии. Если изъязвление обширное, то оно может быть причиной кровотечения, привести к некрозу стенки, ее перфорации и медиастиниту. Хотя бактеремия наблюдается у каждого второго больного, перенесшего склеротерапию, протекает она обычно латентно, а большинство инфекционных осложнений, таких как менингит, паранефрит, абсцесс мозга, эндокардит, бактериальный перитонит, встречаются редко.
Кровотечения
из варикозно расширенных вен дна желудка, развившиеся после
склеротерапии пищеводных
флебэктазий или спонтанно, представляют значительную трудность для
эндоскопического лечения. Гистоакрил (N-бутил-2-цианоакрилат)
является веществом, которое трансформируется из своего естественного
жидкого
состояния в твердое при добавлении к нему физиологической среды,
например
крови. Цианоакрилат, введенный малыми дозами посредством
интраварикозных
инъекций, дает мгновенную
Таблица
5. Осложнения эндоскопической склеротерапии
Местные
Язвы Кровотечения Стриктуры Нарушение моторики пищевода Регионарные
Медиастинит Перфорация Экссудативный плеврит Повышенный риск кровотечения вследствие гастропатии Системные
Сепсис Аспирационная пневмония Гипоксия Спонтанный бактериальный перитонит Тромбоз воротной вены Менингит Паранефрит Абсцесс мозга
Эндокардит |
реакцию
полимеризации и становится твердым, перекрывая просвет вены.
Впервые данный метод был применен во Франции и Германии около двадцати лет назад, при этом описывалась его высокая эффективность, особенно при комбинации со склеротерапией вен пищевода. Имевшие место осложнения включали как преодолимые (диспепсия, дисфагия со стенозом пищевода или без такового, бактеремия, гипертермия), так и фатальные (тромбоэмболия легочной артерии, тромбоз воротной вены), которые, впрочем, были редки. Для их предупреждения рекомендуется ограничить количество вводимого препарата до 1 мл. Сведения о канцерогенных свойствах гистоакрила не подтвердились.
В целом техника применения гистоакрила аналогична интравазальной склеротерапии, но есть и ряд существенных особенностей. Препарат должен быть разбавлен масляным контрастным веществом, например, липиодолом, чтобы предотвратить его преждевременное затвердение внутри или на конце инъекционного катетера во время введения. Последний предварительно слегка заполняется липиодолом, он покрывает внутреннюю стенку катетера и предотвращает прилипание к нему гистоакрила. Для полной уверенности, что весь объем препарата (0,5 мл - для пищеводных, 1 мл - для желудочных варикозов) действительно депонировался в узле, необходимо следом за инъекцией гистоакрила ввести немного дистиллированной воды.
Основным преимуществом данной технологии является возможность быстрого контроля активного варикозного кровотечения и эффективного устранения желудочных флебэктазий. Однако она должна рассматриваться как дополнительная, а не конкурирующая со стандартной склеротерапией.
Эндоскопическое лигирование варикозно расширенных вен пищевода, предложенное в 1986 году G.V. Stiegmann, оказалось более эффективным в отношении рецидивов кровотечений, нежели склеротерапия, способствуя более ранней облитерации варикозов с меньшим количеством осложнений. В отличие от индукции химического воспаления и тромбоза при введении склерозирующих агентов эластично-кольцевая лигатура, захватывая участки слизистого и подслизистого слоев пищевода в области варикозного узла, вызывает странгуляцию и последующий фиброз. Из-за того, что вовлеченный объем ткани мал, возникшие изъязвления всегда поверхностные, и патологические изменения незначительные.
Вместе с тем этот метод имеет ряд технических недостатков. После каждой перевязки эндоскоп должен быть извлечен из пищевода для замены лигатур. Это удлиняет процедуру, что нежелательно при активном кровотечении и у больных с лабильной психикой. Из-за цилиндра, находящегося на конце эндоскопа, происходит сужение поля зрения примерно на 30%. Кроме того, цилиндр препятствует выборочной аспирации крови и слизи, т.к. площадь всасывания увеличивается на его окружность. Не вызывает сомнения, что эти недостатки в недалеком будущем будут устранены, о чем свидетельствуют появившиеся в печати публикации.
Попытки эндоскопически лигировать обширные варикозно расширенные вены дна желудка часто обречены на неудачу ввиду своей неэффективности и вероятности развития в зоне некроза ранних массивных кровотечений. В связи с этим наиболее удобными для перевязки являются вены, расположенные сразу ниже кардии.
При небольших пищеводных варикозах, когда лигирование технически трудновыполнимо, предлагается методика эндоскопического склеролигирования (интравазальная склеротерапия, следующая за лигированием, в сочетании с экстравазальным введением склерозанта).
Хирургическое
лечение
В 1877 году русский хирург Н.В. Экк (1849-1908) в “Военно-медицинском журнале” опубликовал небольшое сообщение “К вопросу о перевязке воротной вены”, в котором были представлены результаты портокавального шунтирования у собак с моделью портальной гипертензии. При этом он показал, что “перемена направления кровяного тока и лишение печени крови воротной вены никаких тяжелых расстройств в организме не производят; животное от операции выздоравливает, питание его по мере выздоровления поправляется и остается далее в отличном состоянии”. Автор заключает: “Опыты в этом направлении я провожу как с целью разъяснения некоторых физиологических вопросов, так и для того, чтобы определить, возможно ли попытать лечить путем образования такого свища некоторые случаи механического асцита. Главную причину сомнений на счет применения этой операции на человеке я считаю устраненной, так как доказано, что кровь воротной вены может быть без опасности для организма отведена непосредственно в общий поток крови и притом помощью совершенно надежной операции”. По сути, с этой работы Н.В. Экка берет свое начало хирургия портальной гипертензии.
В
настоящее время операции, направленные на профилактику и лечение
кровотечений
из варикозно расширенных вен пищевода условно можно разделить на
шунтирующие
(различные варианты портокавальных анастомозов) и нешунтирующие
(деваскуляризирующие
пищевод и желудок операции, а также другие вмешательства, не связанные
с
отведением портальной крови в систему нижней полой вены).
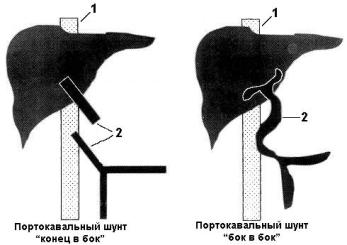
Различные способы неселективного портокавального шунтирования все реже применяются в качестве эффективного метода профилактики рецидивирующих кровотечений из гастроэзофагеальных варикозов. Существенным недостатком этих операций является диверсия портального кровотока. Между тем сохранение постоянства последнего, так же как и венозной гипертензии в кишечном русле, необходимо для поддержания нормальных метаболических процессов в печени. Это приводит к развитию прогрессирующей печеночной недостаточности и тяжелой энцефалопатии, что сопровождается высокой послеоперационной летальностью (рис.11).
|
|
Рис. 11. Типы прямых портокавальных шунтов 1 – нижняя полая вена; 2 – воротная вена. |
Этих недостатков не лишены как стандартный портокавальный анастомоз “конец в бок”, так и разнообразные его модификации. Предлагаемые лечебные мероприятия, направленные на снижение частоты развития и тяжести послеоперационной энцефалопатии, такие как ограничение потребления белка, применение антибиотиков, нормализация аминокислотного состава плазмы и кишечной флоры, в основном безуспешны. Дополнительные технические приемы - артериализация воротной вены, выключение сегмента толстой кишки – показали неутешительные результаты.
За более чем полвека, прошедшие с тех пор, как A.O. Whipple с коллегами выполнили прямое портокавальное шунтирование для профилактики кровотечений из варикозно расширенных вен пищевода, следовало бы ожидать, что проблемы, связанные с его целесообразностью, будут решены. Несмотря на то что уже достаточно хорошо изучена физиология кровообращения печени и предложено много оригинальных модификаций операции, в большинстве случаев остаются присущие им недостатки, которые приводят к неудовлетворительным результатам. Как это нередко встречается в медицине, данный метод был применен раньше понимания патогенеза портальной гипертензии.
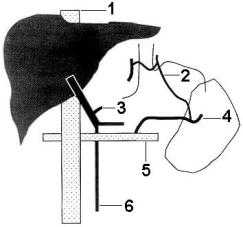
W.D. Warren с соавт. в 1967 году описали метод, который мог бы свести к минимуму свойственные тотальным шунтам осложнения. Он заключается в селективной чрезселезеночной декомпрессии пищеводно-желудочных варикозов путем создания дистального спленоренального анастомоза (рис. 12).
|
|
Рис. 12. Дистальный спленоренальный шунт (по Warren) 1 – нижняя полая вена; 2 – короткие желу-дочные вены; 3 – левая желудочная вена; 4 – селезеночная вена; 5 ‑ левая почечная вена; 6 – верхняя брыжеечная вена. |
Эффективность операции авторы объясняли:
Ø адекватной декомпрессией гастроспленальной сосудистой территории, достичь чего можно только при наличии преимущественного оттока крови из неё через короткие желудочные и диафрагмально-селезёночные вены;
Ø обеспечением нормальной перфузии печени и, таким образом, сохранением метаболических процессов, которые в ней происходят;
Ø постоянством венозной гипертензии в кишечном русле.
Уменьшая давление в шунтированном участке селезеночной вены, операция эффективно разгружает гастроспленальную сосудистую территорию. Однако в гепатопортальной зоне гемодинамические изменения представляются более сложными. Так как портальное давление остается повышенным, даже если его начальные значения уменьшаются при снижении селезеночного кровотока, достичь длительного разделения двух венозных систем высокого и низкого давления посредством селективного шунтирования практически невозможно. Гипертензия в портомезентериальной зоне спустя некоторое время способствует формированию выраженной коллатеральной циркуляции через желудок, поджелудочную железу, толстую кишку по направлению к области низкого давления - гастроспленальной сосудистой территории. Это приводит к уменьшению портального кровотока с высокой вероятностью тромбоза воротной вены. Возникновение так называемого “панкреатического сифона” между воротной и селезеночной венами ухудшает результаты операции, прежде всего за счет прогрессирования печеночной недостаточности и развития энцефалопатии, уровень которой в ряде случаев был аналогичным тотальному шунтированию. Скрупулезное пересечение коллатералей дает возможность избежать этих нежелательных последствий.
Полное спленопанкреатическое разъединение было представлено как модификация дистального спленоренального шунтирования в 1983 году. Отмечалось лучшее сохранение портальной перфузии и повышение выживаемости при сравнении с результатами стандартной операции. Однако ценой этого был повышенный риск рецидива варикозного кровотечения из-за формирования коллатеральной циркуляции в области желудка. Под высоким давлением кровь из воротной вены поступает в сосуды подслизистого слоя малой кривизны желудка по направлению к его коротким венам. Поэтому, несмотря на то что на операции редко встречаются большие варикозы в области печеночно-желудочной связки, лигирование правой желудочной вены тотчас выше привратника должно быть выполнено обязательно. Теоретически и селективная ваготомия за счет пересечения сосудов вдоль малой кривизны желудка, предотвратила бы в дальнейшем развитие трансжелудочных коллатералей.
Опыт показывает, что далеко не всем больным может быть выполнено дистальное спленоренальное шунтирование. Важным условием является проходимость спленопортальной системы, оптимальное расстояние между селезеночной и левой почечной венами и достаточный диаметр этих сосудов, чтобы сформировать анастомоз. Кроме того, левая почечная вена должна иметь нормальное давление и не впадать в нижнюю полую вену ретроаортально. Наличие панкреатита, рефрактерного асцита и гепатофугального портального кровотока являются относительными противопоказаниями к наложению шунта. Большая кровопотеря при выделении селезеночной вены может негативно повлиять на функцию печени во время операции и в послеоперационном периоде. Таким образом, используя критерии отбора, идеальным кандидатом для дистального спленоренального шунтирования может быть лишь каждый десятый больной с портальной гипертензией.
Парциальное (частичное) шунтирование подразумевает анастомоз “бок в бок” через Н-образный политетрафлюороэтиленовый протез диаметром 8-10 мм между воротной, селезеночной или верхней брыжеечной и нижней полой венами. Это позволяет достичь эффективной декомпрессии портальной системы при сохранении адекватного проградиентного кровотока. Установлено, что после операции портопеченочный градиент давления снижается до 12 мм рт. ст., а нормальная перфузия печени при диаметре шунта 8 мм поддерживается у 80% больных. В результате значительно снижается риск развития энцефалопатии, а количество рецидивов кровотечения сопоставимо с тотальным или селективным шунтированием.
К настоящему времени описано большое разнообразие деваскуляризирующих операций и вмешательств, заключающихся в поперечном пересечении нижней части пищевода или верхних отделов желудка с формированием пищеводно-пищеводного или пищеводно-желудочного анастомозов. Они не нарушают функцию печени, однако в большинстве своем сопровождаются высокой частотой рецидивов кровотечений. Хорошо известен метод N.C. Tanner (1961), суть которого состоит в пересечении желудка в области кардии с восстановлением его при помощи сшивающего аппарата. В России распространение получил способ, описанный М.Д. Пациора (1959).
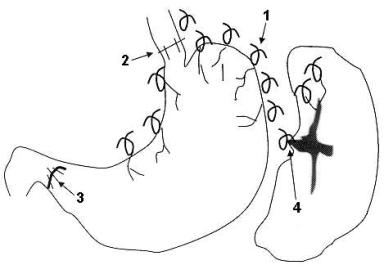
Наиболее эффективным среди нешунтирующих вмешательств является операция, разработанная M. Sugiura (1973) (рис.13). Она требует одновременно трансторакального и
|
|
Рис. 13. Операция Sugiura 1 – деваскуляризация; 2 – пере-сечение и сшивание пищевода; 3 – пилоропластика; 4 – спленэк-томия. |
трансабдоминального доступа и включает в себя пересечение и сшивание пищевода в нижней трети, обширную деваскуляризацию пищевода и желудка от левой нижней легочной вены до верхней половины желудка, спленэктомию, селективную ваготомию и пилоропластику. Послеоперационная летальность, по данным автора, составила 4,9%, десятилетняя выживаемость у пациентов с циррозом печени - 72%, повторные варикозные кровотечения отмечены только у 1,5% больных, лишь 5,2% имели рецидив варикоза. Вместе с тем следует отметить, что подобных уникальных результатов другими клиниками не получено.
Лапароскопическая лазерная реваскуляризация печени
На
кафедре факультетской хирургии Челябинской государственной
медицинской академии разработан и внедрен оригинальный
метод лазерной
реваскуляризации цирротически измененной
печени с
целью снижения портального сосудистого сопротивления, подтвержденный
патентом
РФ на изобретение № 2186545: «Способ хирургического лечения
цирроза печени и
внутрипеченочной портальной гипертензии». Гипотеза о его
целесообразности
основывалась на современных представлениях о патогенезе портальной
гипертензии
и публикациях, посвященных терапевтическому ангиогенезу. Под этим
термином
подразумевают усиление естественных процессов организма по развитию
коллатеральных
сосудов в ишемизированных тканях. Эффективность подобной методики была
подтверждена как у экспериментальных животных при моделировании ишемии
конечностей
или миокарда, так и в клинике.
Формирование
новых кровеносных сосудов – один из наиболее распространённых
и существенных
биологических процессов, происходящих в организме млекопитающих,
играющий
важную роль как в физиологических условиях, так и при различных
патологических
состояниях. В последние 35 лет достигнуты определенные успехи в
понимании его
сути, а также функциональной и клинической значимости коллатерального
кровообращения. Исследования, проведенные в 1960-х годах J.
Folkman,
послужили толчком для изучения механизмов этого уникального
феномена.
Хорошо
известно, что печень животных и человека после повреждения любой
этиологии
обладает уникальной способностью регулировать свой рост и массу, а
также
поддерживать постояноство структуры и функции. Так, резекция части
органа
запускает последовательный
механизм, основными
компонентами которого
являются
клеточная пролиферация и дифференцировка,
миграция клеток, а также реструктуризация стромы и ангиогенез. Факторы,
продуцируемые печенью и внепеченочными тканями, взаимодействуя между
собой и со
специфическими рецепторами клеточных мембран, регулируют этот
компенсаторный
механизм (рис.
14).
|
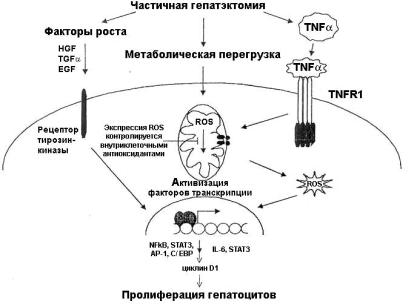
|
Рис. 14. Механизмы регу-ляции регенерации печени (по Fausto) HGF –
гепатоцитарный фак-тор роста; TGF-a ‑
трансформирующий
фактор роста-a; EGF –
эпидермальный фактор роста; TNF-a ‑
туморнекротизирующий
фактор-a;
ROS –
реактивные виды кислорода; NFkB, STAT3, AP-1,
C/EBP –
факторы транскрипции; IL-6 –
интерлейкин-6. |
Метаболическая перегрузка, которой подвергается остаток печени после резекции, а также выработка сенсибилизированными макрофагами туморнекротизирующего фактора-a вызывает образование в гепатоцитах реактивных видов кислорода. Возникший оксидативный стресс активирует факторы транскрипции, такие как NFkB, AP-1, C/EBPb и STAT3. При этом избыток реактивных видов кислорода блокируется разнообразными механизмами, в частности окислением специально выбранных для этой цели субстратов, таких, например, как глютатион, тем самым предотвращая апоптоз.
Активированные
факторы
транскрипции
повышают
экспрессию
большого количества
генов. В начальной
фазе, сразу после операции, проявляют себя
немедленно
ранние гены.
Первыми из них были идентифицированы протоонкогены
c-fos,
c-jun и
c-myc. Вторая
фаза
определяется экспрессией
отсроченно ранних генов, одним
из которых является Bcl-Xl,
а также генами
клеточного цикла, включающими p53,
mdm2, p21, циклины и
циклинзависимые киназы (cdks).
Индукция циклина D1
является
самым надежным маркером прогрессии клеточного цикла
гепатоцитов (G1 фазы).
Сама по
себе экспрессия
немедленно ранних
и
отсроченно
ранних
генов во
время
регенерации печени не ведет к
репликации
ДНК. Для этого
необходимы факторы
роста,
такие
как гепатоцитарный, трансформирующий-a, сосудистый
эндотелиальный и другие. Как
только гепатоциты проходят рестрикционную
точку
и экспрессию циклина D1,
репликация
становится необратимой, и клеточный цикл
заканчивается. Гепатоцитарный фактор роста
является
потенциальным
стимулятором синтеза ДНК в гепатоцитах, при этом взаимодействует
с
другими факторами роста.
Он осуществляет свое действие через
паракринный или эндокринный механизм. В
противоположность ему
трансформирующий фактор роста-a,
вырабатываемый гепатоцитами, оказывает на них аутокринное
влияние,
связываясь
с рецепторами эпидермального
фактора роста.
Сосудистый эндотелиальный фактор роста является основным
хемотаксическим и
митогенным стимулом для эндотелиальных клеток.
Биосинтез белков нескольких функциональных классов, включая факторы транскрипции, роста и сигналпередающие протеины, начинается уже через 5-6 часов после резекции печени (фаза G1). Спустя 10-12 часов наблюдается усиленный синтез ДНК (фаза S), достигая максимума между 24 и 48 часами. Пик синтеза ДНК билиарного эпителия происходит через 36-48 часов, Купферовских и звездчатых клеток – через 48 часов и, наконец, эндотелиальных клеток синусоидов - через 96 часов после операции. Спустя 72 часа после резекции печени, когда пролиферация гепатоцитов снижается, отдельные из них формируют бессосудистые скопления, представляющие собой широкие пластины, состоящие из 10-12 клеток. Пролиферация и инфильтрация бессосудистых скоплений гепатоцитов окружающими их эндотелиальными клетками с последующим восстановлением нормальной сосудистой архитектуры печени ‑ стадии физиологического процесса ангиогенеза (рис. 15).
|
|
|
Рис. 15. Время и стадии процесса ангиогенеза во время регенерации печени (по Ross) |
Морфологическая и морфометрическая оценки препаратов, выполненная нами в процессе экспериментальных исследований с применением как световой, так и электронной микроскопии, подтвердили позитивное влияние лазерного излучения высокой интенсивности на стимуляцию неоангиогенеза в цирротически измененной печени. При этом деструктивные изменения ограничивались лишь зоной некробиоза, вызванной лазерным лучом, за пределами которой он оказывал терапевтическое действие. Полученные результаты позволили сделать заключение о целесообразности применения данного метода в клинике.
Общая характеристика больных, перенесших лазерную реваскуляризацию печени, представлена в табл. 9. Протокол исследования соответствовал этическим рекомендациям, записанным в Хельсинской декларации Всемирной медицинской ассоциации.
Таблица
6. Общая характеристика больных, перенёсших лазерную реваскуляризацию
печени
|
Количество больных |
17 |
|
Средний возраст (лет) |
52,3 ± 3,1 |
|
Мужчины/женщины |
9 (52,9%) / 8 (47,1%) |
|
Этиология цирроза печени: Вирусный
Алкогольный Комбинированный (вирусный+алкогольный) Криптогенный Первичный билиарный цирроз |
6 (35,3%) 5 (29,4%) 2 (11,8%) 3 (17,7%) 1 (5,8%) |
|
Child-класс: А В С |
14 (82,4%) 2 (11,8%) 1 (5,8%) |
|
Размер пищеводных варикозов (в соответствии с классификацией, рекомендованной Японским научным обществом по изучению портальной гипертензии): F1 F2 F3 |
6 (35,3%) 7 (41,2%) 4 (23,5%) |
|
Предшествующие кровотечения: 0 1 >2 |
12 (70,7%) 4 (23,5%) 1 (5,8%) |
Показанием
к операции считали угрозу кровотечения из варикозно расширенных вен
пищевода и
желудка исходя из характера изменений слизистой оболочки пищевода и
желудка, а
также параметров портальной гемодинамики, полученных посредством
ультразвуковой
допплерографии, с учетом прогностических критериев Child-Pugh. Кроме того,
важным условием ее
выполнения был полный отказ больного от приема алкоголя.
|
|
|
|
|
Рис. 16. Лазерная реваскуляризация печени а – пункция передней брюшной стенки для проведения лапароскопии; б ‑ перфорация диафрагмальной поверхности печени лазерным лучом. |
При постановке диагноза и формулировке предоперационного заключения изучали результаты комплексного обследования, включающего оценку общеклинических данных, функциональных проб печени, показателей гемостазиограммы, ультразвуковых методов, фиброэзофагогастроскопии, при необходимости выполняли лапароскопию. В большинстве случаев диагноз был гистологически верифицирован.
Исследование портальной гемодинамики до и после операции проводили на цветном сканере “Acuson-ASPEN” (США) в реальном масштабе времени конвексным датчиком 3,5 МГц с применением импульсной допплерографии натощак в положении лежа на спине из стандартных доступов. Определяли диаметр воротной, селезеночной вен, а также линейную и объемную скорость кровотока по ним. На основании полученных данных рассчитывали индекс застоя в портальной системе.
Техника операции (рис.16). Под эндотрахеальным наркозом посредством лапароскопии в импульсном режиме выполняли посегментарную перфорацию диафрагмальной поверхности печени (15-20 каналов на каждую долю) лазерным лучом, подведенным через гибковолоконный кварцевый световод Æ 0,6 мм на глубину до 2-3 см. В качестве источника излучения использовали диодный лазер SHARPLAN-6020 (Израиль) (l - 810 нм, Р=3-5 Вт).
Отдаленные результаты прослежены на сроки до четырех лет. Операционная летальность (до 30 дней) составила 6%, общая – 24%. В трех случаях причиной смерти была прогрессирующая печеночная недостаточность на фоне злоупотребления алкоголем, в одном – рецидив варикозного кровотечения. Отмечено достоверное снижение индекса застоя в портальной системе с 0,1 ± 0,01 см/с до 0,06 ± 0,01 см/с (p < 0,05), т.е. на 40%.
Эндоваскулярные вмешательства
Эти
методы лечения гастроэзофагеальных варикозов включают в
себя прежде всего трансюгулярное внутрипеченочное портосистемное
шунтирование (TIPS) и
эндоваскулярную эмболизацию
варикозно расширенных вен желудка.
Идея создания фистулы между ветвями печеночной и воротной вен в паренхиме печени, выдвинутая более 30 лет назад J. Rosch, после проведенных экспериментальных исследований получила широкое клиническое применение в последнее десятилетие. Сохранение проходимости шунта обеспечивается наличием внутри него металлического окончатого стента. Главное достоинство TIPS - меньшая инвазивность, чем при хирургических методах декомпрессии.
TIPS функционирует аналогично хирургическому портокавальному шунту «бок в бок» (рис.17). Первоначальный успех превышал 95%, при снижении портопеченочного градиента давления более чем на 35%; операционная летальность составила 13%, общая ‑ 26%. Однако анализ отдаленных результатов показал, что развитие серьезных осложнений сводило к нулю преимущество этого способа лечения.
|
|
|
Рис. 17. Трансюгулярное внутрипечёночное портосистемное шунтирование (TIPS). 1 – печёночная вена; 2 – воротная вена |
Сразу же после наложения TIPS происходит значительное снижение портопеченочного градиента давления, однако, поступление большого количества крови из портального русла приводит к существенному подъему системного венозного давления, повышению венозного возврата и усугублению предсуществующего гипердинамического циркуляторного статуса: еще больше увеличивается сердечный выброс, в то время как системное сосудистое сопротивление снижается. При прогрессировании этих изменений у больных с левожелудочковой недостаточностью может развиться отек легких.
В отличие от хирургической декомпрессии портальной венозной системы рецидив портальной гипертензии после TIPS можно рассматривать как закономерность. Причины чаще всего связаны с нарушением проходимости шунта, перекручиванием и ретракцией стента, развитием правосторонней сердечной недостаточности. Частота стеноза или окклюзии шунта по разным данным колеблется от 16 до 50%. Их причинами были гиперплазия интимы участка печеночной вены или тромбоз эндопротеза из-за низкой скорости кровотока по нему. Энцефалопатия встречается в 20-30% случаев при отсутствии корреляции между выраженностью ее клинических проявлений и степенью дисфункции печени. Другие возможные осложнения TIPS могут быть обусловлены как непосредственно техникой выполнения самой процедуры (перфорация капсулы печени, внутрибрюшные кровотечения, гемобилия), так и индуцированы шунтированием крови (тромбоэмболия легочной артерии, тромбоз воротной вены).
Облитерации желудочного варикоза эндоваскулярными методами можно достичь двояко. В одном случае посредством транспортального введения в левую желудочную вену металлической спирали или эмбола из тефлонового фетра. При этом пищеводно-кардиальная сосудистая зона отключается от воротно-селезеночной. Другой способ предусматривает инъекцию склерозирующего компонента (5% р-р этаноламина олеата с йопамидолом) через катетер с раздуваемым баллончиком, проведённый в правую бедренную или правую внутреннюю яремную вены, а далее - в левую надпочечниковую вену. Таким путём раствор через гастроренальный шунт поступает к венам фундального отдела желудка. Существенным недостатком обеих методик является быстрый рецидив желудочного и ухудшение пищеводного варикоза, что объясняется формированием новых путей коллатерального кровотока. Чтобы повысить эффективность процедур, требуются либо повторные эндоваскулярные вмешательства, либо дополнение их эндоскопической склеротерапией.
ЛЕЧЕБНАЯ ТАКТИКА У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ ПРИ НАЛИЧИИ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА И ЖЕЛУДКА
Первичная профилактика кровотечений из варикозно расширенных вен пищевода и желудка
С тех пор как в 1980 году D. Lebrec сообщил о положительном влиянии пропранолола на портальную гипертензию, было проведено 11 клинических испытаний с плацебоконтролем, во время которых обследовано около 1000 больных. Полученные результаты показали, что неселективные b-адреноблокаторы примерно на 45% уменьшают риск варикозного кровотечения и на 20% величину смертности за 2 года. Они хорошо переносились и были отменены менее чем у 5% пациентов.
Обычно доза неселективных b-адреноблокаторов для первичной профилактики варикозного кровотечения составляет 10-20 мг/сут с учетом того, что она должна подбираться еженедельно. Считается оптимальным, чтобы при их применении ЧСС снижалась на 25% от исходных значений, или примерно до 55 ударов в минуту. Впрочем, это не связано с гемодинамическим эффектом препаратов, поэтому в клинической практике неселективные b-адреноблокаторы назначаются эмпирически до максимально переносимой дозы, ограниченной 160 мг/сут. Ввиду того, что после внезапного прекращения лечения возможно развитие кровотечения (так называемое «кровотечение отказа»), больных необходимо проинструктировать о важности непрерывного приема медикаментов, а вынужденная их отмена должна проводиться под контролем врача. Целесообразно, чтобы лечение этими препаратами было пожизненным.
Однако клинический эффект неселективных
b-адреноблокаторов
на
портальную гипертензию
вариабелен. В ряде
исследований портопеченочный градиент давления не снижался больше чем
на 20% от
исходных значений, а в отдаленный период уменьшение лечебного действия
отмечено
у 50-70% больных. Недостаточная чувствительность может наблюдаться у
лиц
пожилого возраста, при нарушении функции печени. Это важно, поскольку
только из
продолжительного действия препаратов можно извлечь позитивный
результат. Кроме
того, блокада b-адренорецепторов
способна привести к ряду осложнений, из них наиболее клинически важное
значение
имеют бронхоспазм, остановка сердца, импотенция.
Среди органических нитратов в
качестве
средства первичной
профилактики кровотечений из гастроэзофагеальных варикозов используется
только
изосорбида-5-мононитрат. Применение его в качестве монотерапии показало
худшие
результаты, а в комбинации с пропранололом или надололом не удалось
доказать
большую эффективность, чем лечение только неселективными b-адреноблокаторами (табл.7).
Главными
побочными эффектами нитратов являются головная боль (которая
встречается
примерно в 20% случаев) и гипотония. Исследования показали, что при их
комбинации с неселективными b-адреноблокаторами
побочные эффекты встречались у 30-50% больных и послужили причиной
отмены нитратов
у 10-40%.
Если
все же принято решение о лечении нитратами, изосорбида-5-мононитрат
должен назначаться в стартовой дозе 10 мг/сут и подбираться ежедневно
до 40
мг/сут. Доза 10-20 мг/сут может не только лучше переноситься и вызывать
меньше
системных побочных эффектов, но и уменьшать внутрипеченочное и
коллатеральное
сопротивление.
Роль эндоскопических методов в первичной профилактике варикозных кровотечений оценивается неоднозначно. Количество сеансов склеротерапии, необходимых для полной эрадикации пищеводных варикозов, варьирует в широких пределах, и их рецидив наблюдается не менее чем в 60% случаев. Не было отмечено различий и в показателях выживаемости пациентов при сравнении с контрольной группой. Комбинация склеротерапии с неселективными b-адреноблокаторами показала худшие результаты по сравнению с консервативным лечением (табл.7). Применение эндоскопического лигирования способствовало достижению более низкого процента спонтанных кровотечений у больных с варикозом высокой степени риска, с меньшим количеством осложнений по сравнению со склеротерапией. Вместе с тем при сопоставлении эффективности лигирования и неселективных b-адреноблокаторов существенных различий получено не было (табл.7).
В ряде публикаций затрагивался вопрос о применении шунтирующих операций у пациентов, не имевших варикозных кровотечений. Отмечено, что высокая частота развития печеночной энцефалопатии нивелировала положительные результаты таких вмешательств и приводила к выводу о нецелесообразности их применения.
После лазерной реваскуляризации печени случаев кровотечений из варикозно расширенных вен пищевода за период наблюдения отмечено не было. Один больной (Child C) умер на 20-й день, другой (Child A) ‑ через 2 года после операции от прогрессирующей печеночной недостаточности на фоне злоупотребления алкоголем (табл.7).
Таблица
7. Результаты первичной профилактики варикозных кровотечений у больных
циррозом
печени
|
Автор, год публикации |
Кол-во больных |
Алкогольный цирроз (%) |
Child-класс А/В/С (%) |
Частота кровотечений (%) |
Летальность (%) |
|
Контроль/b-адреноблокаторы |
|||||
|
J.P. Pascal (1987) G. Ideo (1988) D. Lebrec (1988) E. Strauss (1988) C. Merkel (1988) IMPP
(1989)* T. Andreani
(1990) J. Colman (1990) H.O. Conn (1991) PROVA
(1991)** H.R. Van Buuren
(1995) |
111/116 49/30 53/53 16/20 50/54 89/85 41/43 25/23 51/51 72/68 43/47 |
90 52 74 - - 40 79 100 78 83 46 |
17/37/46 76/24/- 58/42/- - - - 24/48/28 38/40/22 58/34/8 - - |
27/17 22/3 19/13 25/20 4/0 35/21 32/5 8/35 22/4 18/18 38/30 |
36/22 18/10 19/19 44/35 6/7 31/43 44/30 28/26 22/16 19/10 34/42 |
|
b-адреноблокаторы/изосорбида-5- мононитрат |
|||||
|
G. Borroni (2002) |
25/27 |
- |
- |
8/37 |
32/26 |
|
b-адреноблокаторы+изосорбида-5-мононитрат/b-адреноблокаторы |
|||||
|
C. Merkel (2000) |
16/8 |
- |
- |
12/8 |
25/30 |
|
Склеротерапия |
|||||
|
L. Witzel (1985) H. Koch (1986) G. Piai (1988) W.E. Fleig (1988) E. Strauss (1988) R. Potzi (1989) R. Planas (1989) V.E. Kobe (1990) T. Andreani
(1990) D.R. Triger
(1991) M.E. Concalves
(2000) |
56 30 71 21 18 41 22 30 42 33 50 |
81 63 34 - - 55 - 39 81 43 - |
37/44/19 55/35/10 23/49/28 - - 32/38/30 - 32/46/22 23/51/26 46/40/14 - |
9 30 14 14 22 29 27 30 21 39 24 |
21 37 23 29 39 24 23 47 43 61 - |
|
b-адреноблокаторы/b-адреноблокаторы+склеротерапия |
|||||
|
A. Avgerinos (2000) |
42/44 |
- |
- |
14/23 |
18/14 |
|
b-блокаторы/лигирование |
|||||
|
77/75 |
51 |
- |
22/19 |
33/34 |
|
|
Лазерная реваскуляризация печени |
|||||
|
12 |
33 |
75/17/8 |
0 |
17 |
|
|
*IMPP=Italian
Multicenter Projekt for Propranolol; **PROVA=Prophylaxis of Variceal
Hemorrhage |
|||||
Тактика при острых кровотечениях из варикозно расширенных вен пищевода и желудка
Решающая роль в комплексе консервативных мероприятий по остановке варикозных кровотечений принадлежит трехпросветному зонду-обтуратору Sengstaken-Blakemore, состоящему из желудочного зонда и пневмобаллонов для пищевода и желудка (рис. 18). Вводят его, как правило, через носовой ход первоначально до носоглотки. Затем
|
|
|
|
Рис. 18. Зонд-обтуратор Sengstaken-Blakemore а ‑ схема применения зонда-обтуратора; б – зонд-обтуратор установлен у больной с кровотечением из пищеводных варикозов. |
|
больной набирает в рот глоток воды и одновременно с его проглатыванием быстрыми движениями зонд проталкивают в полость желудка. Через трубку, соединенную с желудочным баллоном, нагнетают в него 50-70 см3 воздуха, зонд подтягивают до ощущения упора в области кардии и фиксируют. После чего порционно раздувают пищеводный баллон до 80-150 см3, лучше до появления болевых ощущений за грудиной. Затем с помощью шприца Жане аспирируют желудочное содержимое и промывают полость желудка до чистых вод. Зонд не удаляют на протяжении 24-72 часов в зависимости от массивности и продолжительности кровотечения, при этом каждые 5-6 часов баллоны распускают. Если признаки кровотечения отсутствуют, от нагнетания в них воздуха можно воздержаться.
Баллонная тампонада имеет преимущество в том плане, что большая часть кровотока по варикозным венам сконцентрирована в области гастроэзофагеального соединения. Она достаточно эффективна в достижении временного гемостаза и часто используется перед операцией в тех случаях, когда другие методы лечения не достигли необходимого результата. Однако при ее применении могут быть тяжелые осложнения. По данным литературы аспирационная пневмония встречается в более чем 10% случаев. В связи с этим, чтобы защитить дыхательные пути, перед баллонной тампонадой целесообразна интубация трахеи, особенно у больных с энцефалопатией. Самые серьезные осложнения являются следствием перемещения желудочного баллона в пищевод, способствуя его перфорации, асфиксии из-за обтурации дыхательных путей или того и другого. Нахождение зонда в пищеводе более 24 часов с раздутыми пневмобаллонами, может привести к некротическим язвам в месте компрессии.
После
распускания пневмобаллонов имеется высокий риск рецидива кровотечения.
В связи
с чем единственная роль этого метода лечения заключается во временной
стабилизации
состояния пациента для определения дальнейшей тактики.
Параллельно с установкой зонда-обтуратора проводится интенсивная заместительная терапия под контролем измерения центрального венозного давления. Нельзя допускать снижения гематокритного числа ниже 25% и падения почасового диуреза ниже 40 мл. Несоблюдение указанных условий ведет к развитию печеночно-клеточной недостаточности и активации цирротического процесса.
Инфузионно-трансфузионная терапия строится исходя из следующих принципов:
ü
назначение
вазоактивных
лекарственных средств, снижающих
портальное давление;
ü использование препаратов гемодинамического действия ‑ полиглюкин, желатиноль, плазма, альбумин;
ü применение гемостатических средств ‑ S-аминокапроновая кислота, викасол, этамзилат, дицинон и др.
ü введение кристаллоидов для улучшения транскапиллярного обмена ‑ раствор Рингера, лактасол и др.;
ü инфузия препаратов, улучшающих реологические свойства крови ‑ реополиглюкин, реоглюман, реомакродекс;
ü трансфузия эритромассы или отмытых эритроцитов.
Вазоактивные препараты, применяемые для остановки кровотечения, должны иметь ряд особенностей:
ü быстро и эффективно снижать портальное давление, не влияя отрицательно на центральную гемодинамику и печеночный кровоток;
ü оказывать минимум побочных действий;
ü при необходимости отмены действие их должно быстро прекращаться.
Первым
из вазоактивных препаратов, использованных при остром кровотечении из
варикозно
расширенных вен пищевода и желудка, был вазопрессин. Вводится он
внутривенно в
дозе 20 ЕД на 200 мл 5% раствора глюкозы в течение 15-20 минут.
Аналогичным
образом применяется его аналог – питуитрин (получивший
наибольшее
распространение в отечественных клиниках). Показано,
что вазопрессин эффективен при
варикозных
кровотечениях, хотя и не уменьшает летальность (табл.8). Осложнения,
связанные
с его использованием в рандомизированных контролируемых исследованиях
составляют 32-64%. Они могут быть достаточно тяжелыми и требовать
прекращения
лечения. Среди последних описаны инфаркт миокарда, нарушения ритма
сердца,
дыхательная недостаточность, цереброваскулярные расстройства, некроз
тонкой
кишки, локальные тканевые некрозы и гипонатриемия вследствие
антидиуретического
действия. О фатальных побочных действиях сообщалось редко.
Таблица
8. Результаты консервативного лечения острых варикозных кровотечений у
больных
циррозом печени
|
Препарат, автор, год публикации |
Кол-во больных |
Алкогольный цирроз (%) |
Child-класс А/В/С (%) |
Отсутствие эффекта (%) |
Леталь-ность (%) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Вазопрессин/плацебо |
|||||
|
H.O. Conn (1975) A. Mallory (1980) R.M. Fogel (1981) |
17/16 18/20 14/19 |
- 84 - |
- - - |
29/75 55/85 71/63 |
53/62 44/45 50/42 |
|
Вазопрессин+нитроглицерин/ вазопрессин |
|||||
|
Y.T. Tsai (1986) A. Gimson (1986) J. Bosch (1989) |
20/19 38/34 30/35 |
- 48 61 |
28/38/34 13/26/61 14/35/51 |
55/79 32/56 27/46 |
55/58 24/26 30/29 |
|
Соматостатин/плацебо |
|||||
|
J.E. Valenzuela (1989) A.K. Burroughs (1990) |
48/36 61/59 |
86 52 |
19/49/32 24/42/34 |
44/25 36/59 |
31/28 15/11 |
|
Соматостатин/вазопрессин |
|||||
M. Bagarani (1987) C. Cardona (198 9) H.C. Fsia (1990) A. Saari (1990) J.S. Hwang (1992) |
24/25 20/18 22/24 32/22 24/24 |
- 58 - 65 16 |
0/31/69 18/55/26 6/28/65 15/39/46 21/35/44 |
33/68 60/44 45/63 35/48 37/54 |
25/40 30/17 63/62 34/36 46/50 |
|
Соматостатин/Соматостатин+ изосорбида-5-мононитрат |
|||||
|
F. Junguera (2000) |
30/30 |
- |
- |
13/40 |
- |
|
Соматостатин/баллонная тампонада |
|||||
|
R. McKee (1990) J.L. Jaramillo
(1991) A. Avgerinos (1991) |
20/20 19/20 31/30 |
81 31 34 |
50/31/19 8/51/41 37/36/27 |
50/30 42/50 32/33 |
0/25 26/25 23/33 |
|
Баллонная тампонада/ вазопрессин (терлипрессин) |
|||||
|
J. Pinto Correia
(1984) J. Teres (1990) D.
Garcia-Compean (1997). |
20/17 52/56 20/20 |
78 59 - |
35/51/13 - - |
30/35 13/34 5/30 |
20/12 31/30 - |
Как указывалось выше нитраты также могут снижать портальное давление. В частности, 1% спиртовой раствор нитроглицерина вводят внутривенно капельно из расчета 1 мл (10 мг) на 400 мл раствора Рингера со скоростью 10-15 капель в минуту. Начинать его применение следует обязательно после выведения больного из шока и стабилизации артериального давления на уровне не ниже 90 мм рт. ст. Продолжительность инфузии нитроглицерина в зависимости от стойкости гемостаза составляет 24-72 часа.
По
сравнению с одним вазопрессином, его сочетание с нитроглицерином
уменьшает риск
развития осложнений, улучшает эффективность гемостаза и незначительно
повышает
выживаемость (табл. 8). Исходя из этого рекомендуется использовать
только их
комбинацию.
В последние годы
при лечении острых варикозных кровотечений получил распространение
препарат
соматостатин и его синтетический аналог сандостатин (октреотид,
вапреотид).
Соматостатин обычно назначается посредством болюсных инъекций 250 мкг,
следующих за продолжительной инфузией 250 мкг/ч. Однако недавние
гемодинамические и клинические исследования показали, что для более
мощного
эффекта необходима доза 500 мкг/ч. Лечение может быть продолжено в
течение 5
дней.
Рандомизированные
контролируемые исследования показали, что соматостатин не имеет
преимуществ по
сравнению с плацебо или баллонной тампонадой и более эффективен, чем
вазопрессин и нитроглицерин при контроле острого варикозного
кровотечения при
схожей величине летальных исходов (табл. 8). Его применение обычно не
оказывает
значительных побочных действий, среди которых наиболее часто
встречаются
брадикардия, гипергликемия, диарея и абдоминальные спазмы.
Терапию
сандостатином начинают с одномоментного назначения ударной дозы 100 мкг
внутривенно, после чего осуществляют внутривенное или подкожное
введение указанной
дозы препарата каждые 2 часа в течение 2 суток. Результаты при
использовании
его в качестве монотерапии противоречивы. Не было обнаружено влияния
сандостатина на частоту повторных кровотечений и летальность. Вместе с
тем он превосходит
вазопрессин и может повышать эффективность эндоскопического лечения.
Для
предотвращения инфекционных осложнений и спонтанного бактериального
перитонита
больным циррозом печени с кровотечением из варикозно расширенных вен
пищевода и
желудка должна быть назначена антибактериальная терапия. Лечение,
направленное
на детоксикацию организма, включает очищение кишечника с помощью
сифонных
клизм. При наличии гепатогенной энцефалопатии после достижения
гемостаза
рекомендуется применять трансинтенстинальную ирригацию растворами
осмотически активных
веществ (лактулоза, дюфалак) через тонкий полихлорвиниловый
назоеюнальный зонд,
проведенный в тонкую кишку с помощью эндоскопа, либо через желудочный
канал
пищеводного зонда-обтуратора. Капельное введение указанных препаратов,
разведенных в 1-1,5 л дистиллированной воды, обеспечивает детоксикацию
организма в течение 2 суток до исчезновения клинических признаков
печеночной
энцефалопатии и появления светлого кала.
Прогнозировать длительность фармакотерапии невозможно, так как рецидив кровотечения может возникнуть в любое время после достижения временного гемостаза. В то же время эти мероприятия позволяют выиграть время для принятия решения о дальнейшей тактике, а именно: о продолжении консервативного лечения, о применении эндоскопических, эндоваскулярных методов, либо об операции.
В комплексной терапии острых варикозных кровотечений у больных циррозом печени могут быть использованы и различные эндоскопические методики (табл. 9). Однако применение их следует ограничить неэффективностью консервативного лечения из-за возможного развития тяжелых осложнений (табл. 5). Более того, даже выполнение диагностической эндоскопии может быть в ряде случаев отсрочено до стабилизации показателей гемодинамики.
Таблица
9. Результаты неотложной эндоскопической склеротерапии (ЭС) при острых
варикозных кровотечениях у больных циррозом печени
|
Автор, год публикации |
Кол-во больных |
Алкогольный цирроз (%) |
Child-класс А/В/С (%) |
Отсутствие эффекта (%) |
Рецидив кровотече-ния (в теч-е 6 нед.) (%) |
Леталь-ность (%) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
ЭС/вазопрессин |
||||||
|
C. Soderlund
(1986) A.W. Larson
(1986) A. El-Zayadi
(1988) D. Westaby (1989) P. Alexandrino
(1990) |
57/50 44/38 63/55 33/31 41/42 |
88 78 - 56 - |
- 16/27/57 43/36/21 18/50/32 12/39/49 |
5/16 - - 12/35 29/29 |
28/32 23/53 16/22 30/26 39/45 |
28/36 5/13 11/20 27/39 39/41 |
|
ЭС/соматостатин |
||||||
|
G. Di Febo (1990) R. Shields (1992) J.J. Sung (1993) R. Planas (1994) R.P. Ramires
(2000) |
24/23 41/39 49/49 35/35 19/21 |
- 68 38 71 42 |
59/41/0 16/31/53 13/43/44 17/49/34 10/68/22 |
8/22 17/23 26/31 17/20 26/24 |
5/22 - - 17/25 36/21 |
21/26 19/31 41/29 23/28 32/29 |
|
ЭС/октреотид |
||||||
|
A. Jenkins (1992) M. Baldozola
(2000) B. Sivri (2000) |
20/20 37/39 36/30 |
- - - |
- - - |
10/10 5/15 25/27 |
- 23/33 22/23 |
- 8/21 - |
|
ЭС/ЭС+вапреотид |
||||||
|
P. Cales (2001) |
98/98 |
- |
- |
50/34 |
- |
- |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
ЭС/ЭС+октреотид |
||||||
|
S.A. Jenkins
(1997) B.F. Zuberi
(2000) |
16/16 35/35 |
- - |
- - |
- 14/6 |
44/6 23/8 |
- 3/3 |
|
ЭС/лигирование |
||||||
|
48/47 |
- |
- |
14/20 |
21/6 |
- |
|
|
ЭС+лигирование/Лигирование |
||||||
|
J. Argonz (2000) |
39/41 |
- |
- |
13/24 |
23/32 |
31/39 |
|
ЭС/баллонная тампонада |
||||||
|
M.S. Barsoum
(1982) K.J. Paquet
(1985) M. Moreto (1988) |
50/50 21/22 23/20 |
- 70 60 |
8/24/67 - 21/47/32 |
- 5/27 0/20 |
26/58 19/38 17/35 |
26/42 9/27 30/30 |
|
ЭС/операция Таннера |
||||||
|
J.P. Cello (1982) W. Huizinga
(1985) J. Teres (1987) A.K. Burroughs
(1989) |
6/7 37/39 15/17 50/51 |
84 - 57 50 |
0/0/100 20/38/42 - 10/35/55 |
- - 27/29 18/4 |
33/0 49/3 - - |
66/71 24/33 47/53 44/37 |
При локализации источника кровотечения в пределах нижней трети пищевода используют методику интравазальной эндоскопической инъекционной склеротерапии. Тотчас после извлечения зонда-обтуратора осуществляют фиброэзофагогастроскопию. Через специальный канал эндоскопа проводят инжектор, при помощи имеющейся на нем иглы в просвет варикозного узла вводят 10 мл 1-3% раствора тромбовара и сразу же концом эндоскопа вену сдавливают до образования тромба. После извлечения аппарата целесообразно вновь установить зонд-обтуратор, а пневмобаллоны раздуть. Обязательным условием является контрольное эндоскопическое исследование через 7-10 дней, при котором оценивают состояние варикозных вен и слизистой оболочки над ними, наличие или отсутствие местных осложнений.
Если есть возможность, эндоскопическую склеротерапию пищеводных варикозов целесообразно комбинировать с инъекцией гистоакрила, а также заменить или сочетать с лигированием.
Пациентов с компенсированным циррозом печени, у которых кровотечение продолжается, несмотря на выше перечисленные мероприятия, необходимо оперировать. При этом предпочтение следует отдавать методу, описанному М.Д. Пациора, суть которого в следующем. Из абдоминального доступа производится гастротомия в проксимальном отделе желудка в косопоперечном направлении. Прошиваются узловыми швами все расширенные складки слизистой оболочки кардиального отдела желудка, под которыми располагаются варикозно расширенные вены. После чего, потягивая за лигатуры, максимально высоко прошиваются варикозно расширенные вены пищевода.
В клиниках, где есть оборудованная соответствующим образом рентгеноперационная, альтернативой операции может быть TIPS. По данным литературы, при его применении в среднем контроль кровотечения составляет 95%, а их рецидивы встречаются в 18% случаев. Высокая летальность, приближающаяся к 38%, объясняется крайне тяжелым состоянием пациентов, с плохим прогнозом вне зависимости от выбранного метода лечения. В связи с чем некоторые авторы рекомендуют ургентное выполнение TIPS ограничить больными со стабильной гемодинамикой, которым не применяется искусственная вентиляция легких, и без инфекционных осложнений.
Профилактика
рецидивов
кровотечений из варикозно расширенных
вен пищевода и желудка
Лечение,
направленное на профилактику повторных варикозных кровотечений, должно
быть своевременным
и быстро давать желаемый эффект, т.к. наибольшая угроза их рецидива
сохраняется
в течение первого месяца.
Хотя
и доказана эффективность неселективных b-адреноблокаторов
в
ближайший постгеморрагический период, стойкого отдаленного
положительного
результата при их применении (снижение портопеченочного градиента
давления ниже
12 мм рт. ст. или, по крайней мере, до 20% от исходного) удаётся
достичь только
у 1/3-1/2 пациентов, а случаи
рецидивов
кровотечения достигают почти 70%
(табл. 10). В связи с этим изучается
возможность
применения
неселективных b-адреноблокаторов
в сочетании с изосорбида-5-мононитратом, празозином, карведилолом.
Одновременное
назначение пропранолола или надолола с изосорбида-5-мононитратом
сравнивалось с
одними неселективными b-адреноблокаторами
в двух рандомизированных контролируемых исследованиях. В одном случае
отмечена
польза от комбинированной терапии,
в другом – преимуществ выявлено не было.
Если
принято решение о проведении эндоскопической склеротерапии
гастроэзофагеальных
варикозов, выполнять
ее
целесообразно уже через 12 часов после достижения
гемостаза
консервативными мероприятиями, а при выборе интервала
между сеансами (от нескольких дней до 6 недель) необходимо учитывать
как
скорость облитерации варикозов, так и опасность тяжёлых повреждений
слизистой
оболочки, связанных с инъекциями в короткие промежутки времени (табл.
5).
В
отношении как рецидивов кровотечений, так и летальности эндоскопическая
склеротерапия эквивалентна применению неселективных b-адреноблокаторов,
но с большей частотой и тяжестью побочных эффектов, однако уступает
комбинации
изосорбида-5-мононитрата с пропранололом или надололом. Сравнение
комбинированной фармакотерапии с лигированием дало противоречивые
результаты.
Одновременное использование медикаментозного лечения вазоактивными
препаратами
с эндоскопическими методами показало превосходство каждого в
отдельности.
Исследования, сравнивающие TIPS
с
сочетанием изосорбида-5-мононитрата и пропранолола, также
как и с эндоскопической склеротерапией, выявили меньшую эффективность
последних
в окончательном гемостазе, но они сопровождаются незначительной
энцефалопатией,
имеют аналогичную летальность и существенно дешевле (табл. 10).
Таблица
10. Результаты нехирургических методов профилактики повторных
варикозных
кровотечений у больных циррозом печени
|
Автор, год публикации |
Кол-во больных |
Алкогольный цирроз (%) |
Child-класс А/В/С (%) |
Рецидив кровотечения (%) |
Летальность (%) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
b-блокаторы/плацебо |
|||||
|
A.K. Burroughs
(1983) D. Lebrec (1984) J.P. Villeneuve
(1986) P. Cerbelaud
(1986) A.M. Queuniet
(1987) E. Kobeet (1987) A. Gatta (1987) M. Colombo (1989) I.S. Sheen (1989) O.J. Garden
(1990) J. Colman (1990) V. Rossi (1991) |
26/22 38/36 42/37 42/42 51/48 26/28 12/12 32/30 18/18 38/43 26/26 27/27 |
42 88 72 98 94 46 75 82 44 70 100 100 |
- 72/28/0 11/52/37 38/46/16 - - 40/58/2 45/55/0 75/25/0 16/37/47 - 22/40/38 |
50/46 21/64 76/81 40/78 57/65 38/46 25/67 25/47 28/55 53/84 35/50 48/63 |
15/23 8/22 45/38 - 23/21 23/32 8/25 12/23 0/11 37/44 4/4 26/33 |
|
Склеротерапия/плацебо |
|||||
|
D. Westaby (1985) C. Soderlund
(1985) J. Korula (1985) A.K. Burroughs
(1989) V. Rossi (1991) L.F. Rikkers
(1993) P.B. Gregory
(1994) J.E. Krige (2000) |
56/60 57/50 63/57 102/102 26/27 30/- 122/131 204/- |
54 89 84 - 100 90 100 81 |
31/41/28 15/20/65 23/30/47 28/48/24 22/40/38 -/-/33 12/43/45 30/91/83 |
55/82 56/66 49/84 56/60 50/63 60/- 55/63 36/- |
32/53 56/70 33/33 47/54 23/33 74/- 63/56 70/- |
|
Склеротерапия+b-блокаторы/b-блокаторы |
|||||
|
K.W.
O’Connor (1989) O. Ink (1992) |
31/31 65/66 |
82 96 |
5/14/81 0/56/44 |
68/87 38/53 |
55/31 26/35 |
|
Склеротерапия/b-блокаторы |
|||||
|
P.T.Alexandrino
(1988) J.M. Dollet 1988) D. Westaby (1990) V. Rossi (1991) T. Martin (1991) S. Dasarathy
(1992) J. Teres (1993) |
31/34 28/27 56/52 26/27 42/34 45/46 58/58 |
80 94 55 100 97 27 58 |
72/28/0 22/51/27 41/59/0 22/40/38 43/33/24 - 16/84/0 |
55/73 64/41 50/56 50/48 55/53 42/67 45/64 |
29/32 53/41 37/42 23/26 31/23 22/41 36/40 |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
TIPS/склеротерапия |
|||||
|
G.V.
Papatheodoridis (1999) |
S 811 |
- |
- |
19/47 |
27/27 |
|
Склеротерапия+b-блокаторы/склеротерапия |
|||||
|
D. Westaby (1986) L.S. Jensen
(1989) L. Lundell (1990) G. Beroni (1990) G.E. Gerunda
(1990) J.P. Vinel (1992) C. Villanueva
(1992) K.S. Acharya
(1993) A. Avgerinos
(1993) C. Vicker (1994) S.S. Elsayed
(1996) |
26/27 15/16 19/22 14/14 30/30 39/35 22/18 58/56 45/40 39/34 200 |
36 84 63 57 50 91 - 6 26 34 - |
16/43/41 26/45/29 22/27/51 32/33/36 - - - - 74/19/7 26/50/24 - |
27/30 20/75 63/50 7/28 20/23 18/40 56/39 17/21 31/52 44/41 14/39 |
35/26 7/6 - 7/21 3/10 13/14 9/0 9/12 18/23 23/26 12/12 |
|
Лигирование |
|||||
|
E. Brena (2000) |
22 |
- |
- |
14 |
0 |
|
Лигирование/b-блокаторы |
|||||
|
D. Patch (2002) |
51/51 |
- |
-/-/51 |
54/44 |
23/32 |
|
Лигирование/склеротерапия |
|||||
|
G.V. Stiegmann
(1992) L. Laine (1993) A. Gimson (1993) M.C. Hou (2000) |
64/65 38/39 54/49 81/58 |
81 79 46 - |
32/48/20 17/60/23 26/46/28 - |
36/48 26/44 30/53 7/12 |
28/45 10/15 - - |
|
Лигирование+склеротерапия/лигирование |
|||||
|
39/41 |
- |
- |
23/32 |
10/22 |
|
|
Лигирование+b-блокаторы/лигирование |
|||||
|
60/62 |
- |
- |
12/29 |
16/32 |
|
|
TIPS/b-адреноблокаторы+изосорбида-5-мононитрат |
|||||
|
47/44 |
- |
- |
13/39 |
38/38 |
|
Рецидивирующие варикозные кровотечения после скрупулезного выполнения указанных выше методов у больных с хорошей функцией печени являются показанием к хирургическому лечению, при этом предпочтение отдается шунтирующим операциям. Неселективные портокавальные шунты в настоящее время исключены из практики большинства ведущих клиник мира. Это связано с высокой послеоперационной летальностью вследствие прогрессирующей печеночной недостаточности, а возникающая энцефалопатия имеет более тяжелое течение, чем исходная (табл. 11).
Таблица
11. Результаты неселективно шунтирующих операций у больных циррозом
печени
|
Автор, год публикации |
Операция |
Кол-во больных |
Операци-онная ле- тальность (%) |
Выживае-мость (%) |
Энцефа-лопатия (%) |
Рецидив крово-течения (%) |
Печеночная недостаточ-ность (%) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
ПКА* ПКА** |
25 21 |
20 5 |
64 48 |
32 14 |
4 5 |
24 33 |
|
|
L.F. Rikkers
(1978) |
ПКА |
29 |
10 |
45 |
58 |
- |
- |
|
B. Langer (1980) |
ПКА |
28 |
0 |
68 |
50 |
- |
- |
|
F. Villamil
(1981) |
ПКА |
29 |
21 |
59 |
23 |
- |
- |
|
J.E. Fischer
(1981) |
ПКА |
16 |
25 |
62 |
12 |
- |
- |
|
S. Stipa (1984) |
МКА* ПКА** |
109 146 |
7 8 |
19 17 |
43 38 |
11 4 |
35 35 |
|
K.J. Paquet
(1987) |
МКА* |
86 |
8 |
61 |
9 |
6 |
17 |
|
N.D. Grace (1988) |
ПКА* ПКА** МКА ПСРА |
å 38 |
å 13 |
å 45 |
S 45 |
å 12 |
- |
|
W.H. Chang (1988) |
МКА** |
85 |
2 |
88 |
4 |
6 |
- |
|
G.P. Spina (1988) |
ПКА** |
47 |
2 |
- |
35 |
2 |
9 |
|
I.J. Sarfeh
(1994) |
ПКА*** |
16 |
13 |
75 |
64 |
0 |
- |
|
Y. Huang (2000) |
ПКА |
492 |
7 |
- |
14 |
11 |
- |
|
В.М. Лебезев (2001) |
ПКА ПСРА |
11 28 |
36 29 |
- - |
82 14 |
- - |
64 7 |
|
Ф.Г. Назыров (2003) |
ПСРА |
122 |
16 |
- |
23 |
9 |
53 |
Примечание: ПКА –
портокавальный
анастомоз (модификация не
указана); ПКА* - портокавальный анастомоз «конец в
бок»; ПКА** - портокавальный
анастомоз «бок в бок»; ПКА*** - портокавальный
анастомоз с Н-вставкой; ПСРА –
проксимальный спленоренальный анастомоз; МКА –
мезентерикокавальный анастомоз;
МКА* - мезентерикокавальный анастомоз с Н-вставкой; МКА** -
мезентерикокавальный анастомоз «бок в бок».
Селективные и парциальные шунты столь же эффективно предотвращают рецидивы кровотечений из гастроэзофагеальных варикозов, но имеют меньшее количество осложнений, характерных для неселективно шунтирующих операций (табл. 12).
Таблица
12. Результаты парциального (частичного) и дистального спленоренального
(по Warren)
шунтирования у
больных циррозом печени
|
Автор, год публикации |
Операция |
Кол-во больных |
Операци-онная ле- тальность (%) |
Выживае-мость (%) |
Энцефа-лопатия (%) |
Рецидив крово-течения (%) |
Печеночная недостаточ-ность (%) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
ДСРА |
27 |
5
(19%) |
19
(70%) |
3
(14%) |
- |
- |
|
|
F. Villamil
(1981) |
ДСРА |
24 |
2
(8%) |
18
(75%) |
6
(32%) |
- |
- |
|
H.O. Conn (1981) |
ДСРА |
23 |
1
(4%) |
19
(83%) |
1
(5%) |
- |
- |
|
J.E. Fischer
(1981) |
ДСРА |
19 |
2
(11%) |
14
(74%) |
2
(12%) |
- |
- |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
G. Pezzuoli
(1987) |
ДСРА |
106 |
5 |
63 |
17 |
9 |
- |
|
N.D. Grace (1988) |
ДСРА |
43 |
9 |
53 |
47 |
16 |
14 |
|
G.P. Spina (1988) |
ДСРА |
46 |
2 |
- |
19 |
9 |
0 |
|
R.L. Mitchell
(1988) |
ДСРА |
43 |
5 |
79 |
7 |
- |
7 |
|
E.B. Rypins
(1988) |
ПКА |
43 |
- |
58 |
- |
- |
37 |
|
K.-J. Paquet
(1989) |
ДСРА |
32 |
8 |
78 |
0 |
0 |
- |
|
L.F. Rikkers
(1993) |
ДСРА |
30 |
- |
53 |
30 |
17 |
- |
|
R. Gusberg (1993) |
ДСРА |
19 |
0 |
74 |
16 |
0 |
21 |
|
C.H.
Scudamore
(1996) |
МКА |
15 |
0 |
- |
20 |
0 |
- |
|
J. Cai (1998) |
ДСРА |
66 |
8 |
71 |
14 |
8 |
- |
|
X. Leng (1998) |
ПКА |
20 |
- |
- |
5 |
- |
- |
|
D.J.
Hillebrand
(2000) |
ПКА |
18 |
0 |
78 |
17 |
6 |
- |
|
M.A. Mercado
(2000) |
МКА |
33 |
3 |
36 |
11 |
15 |
- |
|
J.S. Khaitiyar
(2000) |
ДСРА |
32 |
- |
81 |
19 |
6 |
- |
|
T. Tajiri (2000) |
ДСРА |
24 |
- |
91 |
30 |
- |
- |
|
M.A. Mercado
(2001) |
ДСРА |
61 |
1 |
92 |
10 |
5 |
- |
|
В.М. Лебезев (2001) |
ДСРА МКА СРА |
33 28 40 |
19 11 8 |
- - - |
9 11 10 |
- - - |
6 11 10 |
|
L.L. Wong (2002) |
ДСРА |
34 |
9 |
82 |
- |
3 |
- |
|
H. Hu (2004) |
ПКА |
31 |
10 |
90 |
13 |
0 |
- |
Примечание: ДСРА –
дистальный спленоренальный анастомоз; МКА - мезентерикокавальный
анастомоз с
Н-вставкой малого диаметра; СРА – спленоренальный анастомоз с
Н-вставкой малого
диаметра; ПКА – портокавальный анастомоз с Н-вставкой малого
диаметра
Лазерная реваскуляризация печени для профилактики повторных варикозных кровотечений была применена у 5 больных. Она была эффективна в 3 случаях. Ближайший послеоперационный период протекал без осложнений. Умерло 2 пациента. Один вследствие рецидива кровотечения, другой - от прогрессирующей печеночной недостаточности.
В последние годы у больных циррозом с тяжелыми нарушениями функции печени и большим операционным риском для адекватной портальной декомпрессии выполняется TIPS. Эта процедура не является панацеей, однако способствует так называемому “эффекту благополучия”. Создание внутрипеченочного сосудистого канала вызывает неоваскуляризацию печени, которая имеет важное клиническое значение. Т.к. TIPS сопровождается рядом серьезных осложнений, его рассматривают как своеобразный «мостик» к трансплантации печени.
ЗАКЛЮЧЕНИЕ
Вся история лечения синдрома портальной гипертензии подразумевает прежде всего борьбу с ее главным клиническим проявлением ‑ гастроэзофагеальными варикозами и кровотечением из них. Это грозное осложнение у больных циррозом печени сопровождается значительной летальностью, которая в несколько раз выше, чем от острого инфаркта миокарда. Однако вызывает недоумение то обстоятельство, что, тогда как при наличии тяжелой сердечной патологии пациенты, как правило, лечатся в специализированных палатах интенсивной терапии, редкие клиники имеют профильные отделения, оказывающие помощь больным с портальной гипертензией в полном объеме.
В конце XX века достигнуты определенные успехи в понимании механизмов развития портальной гипертензии при циррозе печени, что способствовало разработке новых, патогенетически обоснованных способов лечения этого серьезного заболевания. В частности, нами в комплекс терапевтических мероприятий у больных циррозом и варикозным расширением вен пищевода и желудка была включена разработанная в клинике лапароскопическая лазерная реваскуляризация печени (рис. 19).
Подтвердив теоретические предпосылки экспериментальными данными, она была внедрена в практику, где отмечено ее позитивное влияние на течение портальной гипертензии. Как и абсолютное большинство других методов, это вмешательство имеет свои преимущества и недостатки и носит сугубо паллиативный характер. Автор с чувством глубокой признательности примет все конструктивные критические замечания и предложения по обсуждаемой проблеме, которые просит направлять по адресу:
454080, г. Челябинск, а/я 12317
Гарбузенко Дмитрию Викторовичу
E.mail:
garb@inbox.ru
http: // garbuzenko.narod.ru
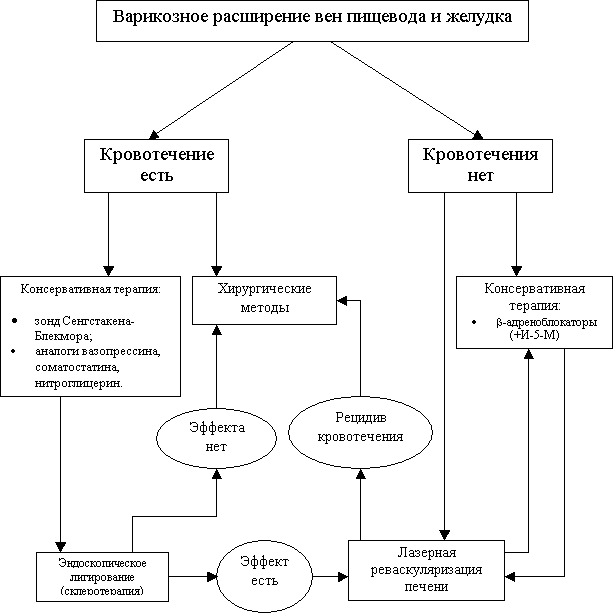
Рис. 19. Предлагаемая тактика ведения больных с варикозным расширением вен пищевода и желудка при циррозе печени
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Гранов А. М., Борисов А. Е. Эндоваскулярная хирургия печени. - Л.: Медицина, 1986. - 224 с.
2. Гугушвили Л.Л. Ретроградное кровообращение печени и портальная гипертензия. - М.: Медицина, 1972. - 196 с.
3. Ерамишанцев А.К., Киценко Е.А., Нечаенко А.М. Операции на пищеводе и желудке у больных с портальной гипертензией // Клин. перспективы гастроэнтерол., гепатол.- 2002. - № 6. - С.8-14
4. Ерамишанцев А. К. Эволюция хирургического лечения кровотечений из варикозно расширенных вен пищевода и желудка // 50 лекций по хирургии / Под ред. В.С. Савельева. - М.: Издательский дом "Медиа Медика", 2003. - С. 261-267
5. Митьков В. В. Допплерография в диагностике заболеваний печени, желчного пузыря, поджелудочной железы и их сосудов. - М.: Издательский дом “Видар-М”, 2000. - 152 с.
6. Пациора М. Д. Хирургия портальной гипертензии. - Ташкент: Медицина, 1984. - 320 с.
7. Петровский Б. В., Цацаниди К. Н., Кадощук Ю. Т. Хирургия портальной гипертензии (атлас). - М.: АО “Медигрант”, 1994. - 183 с.
8. Серов В. В., Лапиш К. Морфологическая диагностика заболеваний печени. - М.: Медицина, 1989. - 336 с.
9. Углов Ф. Г., Корякина Т. О. Хирургическое лечение портальной гипертензии. - Л.: Медицина, 1964. - 220 с.
10. Шалимов А. А., Береснев А. В., Короткий В. Н., Назаренко П. М. Хирургическое лечение и профилактика осложнений цирроза печени. - Киев: Здоров’я, 1988. - 136 с.
11.
Шерлок Ш.,
Дули Дж. Заболевания печени и
желчных путей.
- М.: Гэотар
Медицина, 1999.
- 860
с.
12.
Шерцингер
А.Г. Тактика при острых кровотечениях из варикозно расширенных вен
пищевода и желудка
// Рос. журн. гастроэнтерол., гепатол., колопроктол. - 2001. - Т. XI, №
3.-
С.40-45
13.
Conn H. O.
Transjugular intrahepatic portal-systemic shunts: The state of the
art //
Hepatology. - 1993. -Vol. 17, № 1. - P.148-158
14.
D'Amico G.,
Pagliaro L., Bosch J. The treatment of portal
hypertension: A
meta-analytic review // Hepatology. - 1995.- Vol. 22, № 1.- P.332-354
15.
David A.,
Iannitti D. A., Henderson J. M. The
role of surgery in the
treatment of portal hypertension // Clin. Liver. Dis. - 1997. - Vol. 1,
№ 1.-
P.99-114
16.
De Franchis R.
Updating consensus in portal hypertension:report of the Baveno III
consensus
workshop on definitions, methodology and therapeutic strategies in
portal
hypertension // J. Hepatol. - 2000. - Vol. 33.- P.
846-852
17.
Fausto N.
Liver regeneration // J.
Hepatol. -
2000. - Vol. 32, № 1 (Suppl). - P. 19-31
18.
Lamireau T.,
Desmouliere A.,
Bioulac-Sage P., Rosenbaum J. Mecanismes de la
fibrogenese hepatique
// Arch. Pediatr. - 2002. -Vol. 9, №4. - P. 392-405
19.
Michielsen P. P,
Pelckmans P. A. Hemodynamic changes in portal
hypertension: new insights
in the pathogenesis and clinical implications // Acta gastroenterol.
belg. -
1994.- Vol. 57.- P. 194-205
20.
Ross M. A.,
Sander C. M., Kleeb T. B., et al.
Spatiotemporal expression
on angiogenesis growth factor receptors during the revascularization of
regenerating rat liver // Hepatology. - 2001.- Vol. 34, № 6. - P.
1135-1148
21.
Vlachogiannakos J.,
Goulis J., Patch D.,
Burroughs A. K. Review article:
primary prophylaxis for portal hypertensive bleeding in cirrhosis //
Aliment.
Pharmacol. Ther. - 2000.- Vol. 14, № 7. - P. 851-860
22.
Warren W. D.,
Zeppa R., Fomon J. J. Selective transplenic
decompression of
gastroesophageal varices by distal splenorenal shunt // Ann. Surg.-
1967.- Vol.
166, № 5.- P. 437-455
СОДЕРЖАНИЕ

|
ВВЕДЕНИЕ |
4 |
|
АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ КРОВООБРАЩЕНИЯ ПЕЧЕНИ |
5 |
|
Хирургическая анатомия сосудов печени |
5 |
|
Морфология печени |
7 |
|
Особенности перфузии печени |
10 |
|
ПАТОГЕНЕЗ КРОВОТЕЧЕНИЙ ИЗ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА И ЖЕЛУДКА У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ |
15 |
|
Патогенез портальной гипертензии при циррозе печени |
15 |
|
Механизм формирования пищеводно-желудочных варикозов |
19 |
|
Факторы риска и исход кровотечений из варикозно расширенных вен пищевода и желудка |
22 |
|
ЛЕЧЕНИЕ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ |
25 |
|
Фармакотерапия |
25 |
|
Эндоскопические методы |
30 |
|
Хирургическое лечение |
32 |
|
Лапароскопическая лазерная реваскуляризация печени |
37 |
|
Эндоваскулярные вмешательства |
42 |
|
ЛЕЧЕБНАЯ ТАКТИКА У БОЛЬНЫХ ЦИРРОЗОМ ПЕЧЕНИ ПРИ НАЛИЧИИ ВАРИКОЗНО РАСШИРЕННЫХ ВЕН ПИЩЕВОДА И ЖЕЛУДКА |
45 |
|
Первичная профилактика кровотечений из варикозно расширенных вен пищевода и желудка |
45 |
|
Тактика при острых кровотечениях из варикозно расширенных вен пищевода и желудка |
48 |
|
Профилактика рецидивов кровотечений из варикозно расширенных вен пищевода и желудка |
54 |
|
ЗАКЛЮЧЕНИЕ |
59 |
|
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА |
61 |